তিনটি মৌলিক গ্যাস আইন রয়েছে (বয়েলের আইন, চার্লসের আইন এবং অ্যাভোগাড্রোর আইন) যা চাপ, তাপমাত্রা, আয়তন এবং গ্যাসের পরিমাণের সম্পর্ক বর্ণনা করে। এই পাঠে, আমরা নিম্নলিখিত আলোচনা করব
এর নামকরণ করা হয়েছে রবার্ট বয়েলের নামে।
এটি বলে যে আয়তন চাপের বিপরীতভাবে সমানুপাতিক হয় যখন তাপমাত্রা এবং অণুর সংখ্যা স্থির থাকে।
\(P ∝ 1/V\)
\(P = k_1V\)
কোথায়,
P হল চাপ
V হল ভলিউম
এবং, k 1 হল সমানুপাতিক ধ্রুবক
এখন, যদি স্থির তাপমাত্রায় গ্যাসের একটি নির্দিষ্ট ভরের প্রসারণ ঘটে তাহলে চূড়ান্ত আয়তন এবং চাপ হবে P 2 এবং V 2 ।
এখানে প্রাথমিক আয়তন এবং প্রাথমিক চাপ হল P 1 এবং V 1 , তারপর বয়েলের সূত্র অনুসারে:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
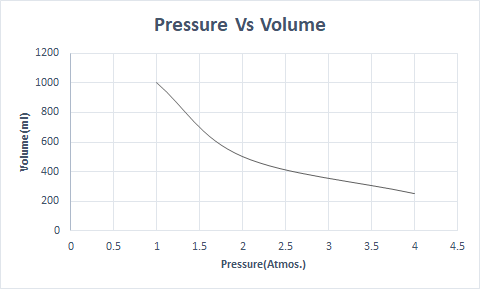
এইভাবে, একটি স্থির তাপমাত্রায়, চাপ দ্বিগুণ হলে, সেই গ্যাসের আয়তন অর্ধেক হয়ে যায়। একটি মুক্ত অবস্থায়, একটি বায়বীয় পদার্থ ছড়িয়ে ছিটিয়ে থাকা অণুর কারণে পাত্রের একটি বড় আয়তন দখল করে। যখন বায়বীয় পদার্থের উপর চাপ প্রয়োগ করা হয়, তখন এই অণুগুলি কাছাকাছি আসে এবং একটি কম আয়তন দখল করে। অন্য কথায়, চাপ প্রয়োগ করা গ্যাসের ঘনত্বের সাথে সরাসরি সমানুপাতিক।
এখানে বয়েলের আইনের গ্রাফিকাল উপস্থাপনা রয়েছে:
উচ্চ উচ্চতায়, বায়ুমণ্ডলীয় চাপ কম তাই বায়ু কম ঘন হয়। ফলে শ্বাস-প্রশ্বাসের জন্য কম অক্সিজেন পাওয়া যায়। এই কারণেই পর্বতারোহীরা অক্সিজেন সিলিন্ডার বহন করে।
1787 সালে, জ্যাক চার্লস একটি ধ্রুবক চাপে একটি গ্যাসীয় পদার্থের আয়তনের উপর তাপমাত্রার প্রভাব অধ্যয়ন করেন। চার্লসের আইন বলে যে ধ্রুব চাপ এবং ধ্রুবক ভরে, গ্যাসের আয়তন তাপমাত্রার সাথে সরাসরি সমানুপাতিক।
\(V ∝ T\)
\(V = yT\)
যেখানে গ্যাস এবং চাপের পরিমাণের উপর নির্ভর করে y একটি ধ্রুবক।
চার্লসের আইনকে এভাবে প্রকাশ করা হয়:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
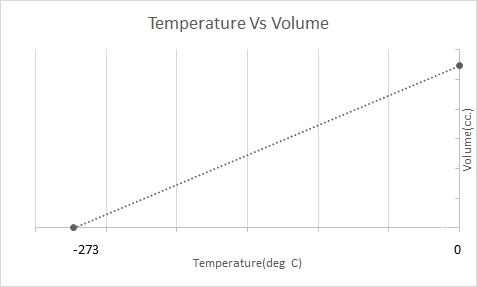
এর মানে হল যে তাপমাত্রা বৃদ্ধির সাথে আয়তন বৃদ্ধি পাবে; তাপমাত্রা হ্রাসের সাথে, আয়তন হ্রাস পায়। তার পরীক্ষায়, তিনি গণনা করেছেন যে একটি গ্যাসের প্রদত্ত ভরের আয়তন যথাক্রমে প্রতিটি ডিগ্রী বৃদ্ধি বা হ্রাসের সাথে সাথে মূল আয়তনের 1/273.15 গুণ বৃদ্ধি বা হ্রাস পায়।
অতএব, যদি আয়তন V 0 হয় 0 O C তে এবং V t আয়তন হয় t o C তে তাহলে,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
এখানে চার্লস আইনের গ্রাফিকাল উপস্থাপনা রয়েছে:
গরম বাতাসের বেলুন চার্লসের আইনের ভিত্তিতে কাজ করে। যখন একটি বার্নার বেলুনের ভিতরে আটকে থাকা বাতাসকে গরম করে, তখন বায়ুর অণুগুলি দ্রুত চলতে শুরু করে এবং প্রসারিত হয়। বেলুনের ভিতরের গ্যাসটি বেশি জায়গা নেয়, এটির চারপাশের বাতাসের চেয়ে কম ঘন হয়। গরম বাতাসের বেলুনটি কম ঘন হওয়ার সাথে সাথে এটি উপরে উঠে এবং ভাসতে থাকে।
এটি চাপ আইন নামেও পরিচিত। এটি 1808 সালে জোসেফ লুই গে-লুসাক দ্বারা প্রণয়ন করা হয়েছিল।
গে লুসাকের আইন বলে যে ধ্রুবক আয়তনে, একটি আদর্শ গ্যাসের চাপ তার পরম তাপমাত্রার (কেলভিনে) সরাসরি সমানুপাতিক।
\(P ∝ T\)
\(P/T = k \)
কোথায়
গে-লুসাকের আইনকে এভাবে প্রকাশ করা যেতে পারে:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
কোথায়:
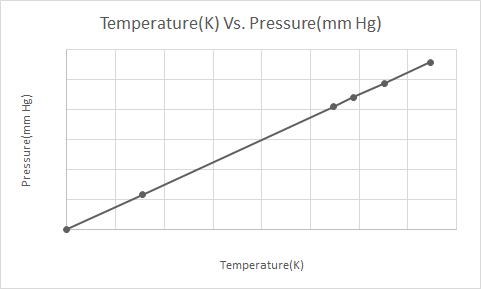
গে-লুসাকের আইন অনুসারে, গ্যাসের চাপ (স্থির ভলিউমে রাখা) ক্রমাগত হ্রাস পায় কারণ এটি ঠান্ডা হয় যতক্ষণ না গ্যাস শেষ পর্যন্ত ঘনীভূত হয় এবং তরলে পরিণত হয়।
এখানে গে-লুসাকের আইনের গ্রাফিক্যাল উপস্থাপনা
যখন একটি চাপযুক্ত অ্যারোসোল ক্যান (যেমন ডিওডোরেন্ট ক্যান বা স্প্রে-পেইন্ট ক্যান) উত্তপ্ত হয়, তখন পাত্রে গ্যাসের চাপ বৃদ্ধির ফলে বিস্ফোরণ ঘটতে পারে। এই কারণেই অনেক চাপযুক্ত পাত্রে সতর্কতামূলক লেবেল থাকে যে কন্টেইনারকে আগুন থেকে দূরে রাখতে হবে এবং একটি শীতল পরিবেশে সংরক্ষণ করতে হবে।
যখন একটি প্রেসার কুকার গরম করা হয়, তখন পাত্রের ভিতরে বাষ্প দ্বারা প্রবাহিত চাপ বৃদ্ধি পায়। পাত্রের ভিতরে উচ্চ তাপমাত্রা এবং চাপের কারণে খাবার দ্রুত রান্না হয়।