Es gibt drei grundlegende Gasgesetze (Boyle's Law, Charles' Law und Avogadro's Law), die die Beziehung zwischen Druck, Temperatur, Volumen und Gasmenge beschreiben. In dieser Lektion werden wir Folgendes besprechen
Es ist nach Robert Boyle benannt.
Diese besagt, dass das Volumen umgekehrt proportional zum Druck ist, wenn die Temperatur und die Anzahl der Moleküle konstant sind.
\(P ∝ 1/V\)
\(P = k_1V\)
wo,
P ist der Druck
V ist das Volumen
und k 1 ist die Proportionalitätskonstante
Wenn nun eine feste Gasmasse bei konstanter Temperatur expandiert, dann sollen das Endvolumen und der Enddruck P 2 und V 2 sein.
Anfangsvolumen und Anfangsdruck sind hier P 1 und V 1 , dann gilt nach dem Gesetz von Boyle:
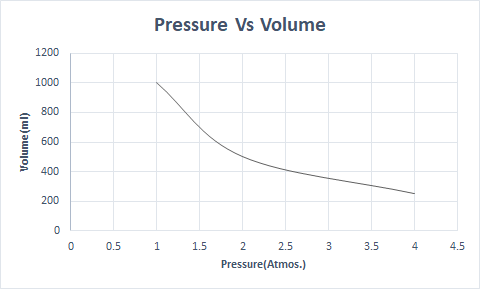
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Wenn also bei konstanter Temperatur der Druck verdoppelt wird, wird das Volumen dieses Gases auf die Hälfte reduziert. Im freien Zustand nimmt eine gasförmige Substanz aufgrund der gestreuten Moleküle ein größeres Volumen des Behälters ein. Wenn Druck auf die gasförmige Substanz ausgeübt wird, kommen diese Moleküle näher und nehmen ein geringeres Volumen ein. Mit anderen Worten, der angelegte Druck ist direkt proportional zur Dichte des Gases.
Hier ist die grafische Darstellung von Boyles Gesetz:
In größerer Höhe ist der atmosphärische Druck niedrig, sodass die Luft weniger dicht ist. Dadurch steht weniger Sauerstoff zum Atmen zur Verfügung. Aus diesem Grund tragen Bergsteiger Sauerstoffflaschen.
1787 untersuchte Jacques Charles den Einfluss der Temperatur auf das Volumen einer gasförmigen Substanz bei konstantem Druck. Das Gesetz von Charles besagt, dass bei konstantem Druck und konstanter Masse das Volumen eines Gases direkt proportional zur Temperatur ist.
\(V ∝ T\)
\(V = yT\)
Wobei y eine Konstante ist, die von der Gasmenge und dem Druck abhängt.
Das Gesetz von Charles wird ausgedrückt als:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
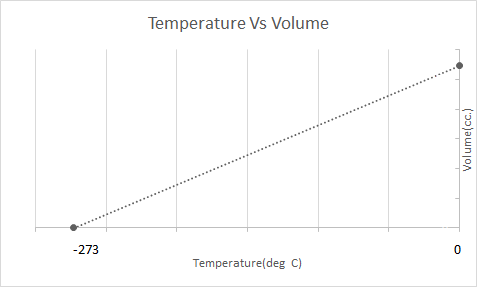
Das heißt, mit steigender Temperatur soll das Volumen zunehmen; mit sinkender Temperatur nimmt das Volumen ab. In seinem Experiment berechnete er, dass das Volumen einer gegebenen Masse eines Gases mit jedem Grad Temperaturanstieg bzw. -abfall um das 1/273,15-fache des ursprünglichen Volumens zu- oder abnimmt.
Wenn also das Volumen V 0 bei 0 ° C ist und V t das Volumen bei t o C ist, dann gilt:
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Hier ist die grafische Darstellung des Karlsgesetzes:
Heißluftballons funktionieren auf der Grundlage des Karlsgesetzes. Wenn ein Brenner die im Ballon eingeschlossene Luft erhitzt, beginnen sich die Luftmoleküle schneller zu bewegen und dehnen sich aus. Das Gas im Inneren des Ballons nimmt mehr Platz ein und wird weniger dicht als die ihn umgebende Luft. Wenn der Heißluftballon an Dichte verliert, steigt er auf und schwebt.
Dies wird auch als Druckgesetz bezeichnet. Es wurde 1808 von Joseph Louis Gay-Lussac formuliert.
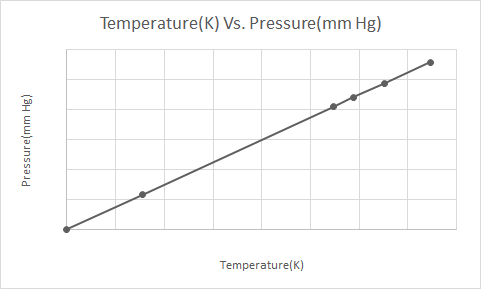
Das Gesetz von Gay Lussac besagt, dass bei konstantem Volumen der Druck eines idealen Gases direkt proportional zu seiner absoluten Temperatur (in Kelvin) ist.
\(P ∝ T\)
\(P/T = k \)
wo
Das Gesetz von Gay-Lussac kann wie folgt ausgedrückt werden:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Wo:
Gemäß dem Gay-Lussac-Gesetz nimmt der Druck eines Gases (bei konstantem Volumen gehalten) beim Abkühlen ständig ab, bis das Gas schließlich kondensiert und flüssig wird.
Hier ist die grafische Darstellung des Gay-Lussac-Gesetzes
Beim Erhitzen einer unter Druck stehenden Aerosoldose (z. B. Deo- oder Lackspraydose) kann es durch den dadurch entstehenden Druckanstieg der Gase auf den Behälter zu einer Explosion kommen. Aus diesem Grund sind viele Druckbehälter mit Warnschildern versehen, die darauf hinweisen, dass der Behälter von Feuer ferngehalten und in einer kühlen Umgebung gelagert werden muss.
Wenn ein Schnellkochtopf erhitzt wird, erhöht sich der Druck, der durch den Dampf im Inneren des Behälters ausgeübt wird. Die hohe Temperatur und der hohe Druck im Inneren des Behälters bewirken, dass die Speisen schneller garen.