Hay tres leyes fundamentales de los gases (Ley de Boyle, Ley de Charles y Ley de Avogadro) que describen la relación de presión, temperatura, volumen y cantidad de gas. En esta lección, discutiremos lo siguiente
Lleva el nombre de Robert Boyle.
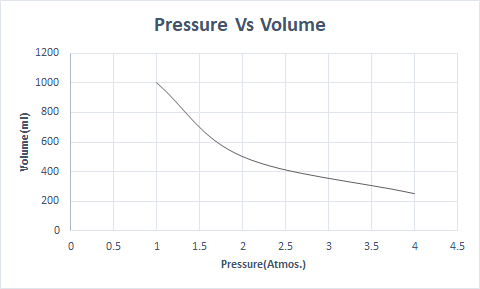
Esta establece que el volumen es inversamente proporcional a la presión cuando la temperatura y el número de moléculas son constantes.
\(P ∝ 1/V\)
\(P = k_1V\)
donde,
P es la presión
V es el volumen
y, k 1 es la constante de proporcionalidad
Ahora bien, si una masa fija de gas experimenta una expansión a temperatura constante, entonces el volumen y la presión finales serán P 2 y V 2 .
El volumen inicial y la presión inicial aquí son P 1 y V 1 , luego de acuerdo con la ley de Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Así, a temperatura constante, si se duplica la presión, el volumen de ese gas se reduce a la mitad. En estado libre, una sustancia gaseosa ocupa un mayor volumen del recipiente debido a las moléculas dispersas. Cuando se aplica presión a la sustancia gaseosa, estas moléculas se acercan y ocupan un volumen menor. En otras palabras, la presión aplicada es directamente proporcional a la densidad del gas.
Aquí está la representación gráfica de la Ley de Boyle:
A mayor altitud, la presión atmosférica es baja, por lo que el aire es menos denso. Como resultado, hay menos oxígeno disponible para respirar. Esta es la razón por la que los montañeros llevan cilindros de oxígeno.
En 1787, Jacques Charles estudió el efecto de la temperatura sobre el volumen de una sustancia gaseosa a presión constante. La Ley de Charles establece que a presión constante y masa constante, el volumen de un gas es directamente proporcional a la temperatura.
\(V ∝ T\)
\(V = yT\)
Donde y es una constante que depende de la cantidad de gas y la presión.
La ley de Charles se expresa como:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
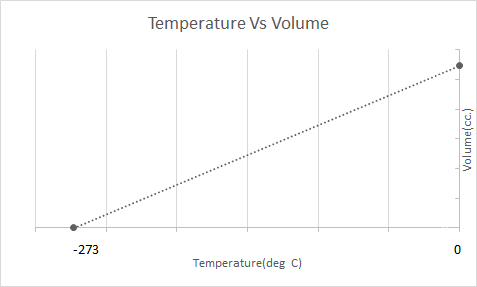
Esto quiere decir que con el aumento de la temperatura el volumen aumentará; al disminuir la temperatura, el volumen disminuye. En su experimento, calculó que el volumen de una masa dada de un gas aumenta o disminuye en 1/273,15 veces el volumen original con cada grado de aumento o disminución de la temperatura, respectivamente.
Por lo tanto, si el volumen es V 0 a 0 O C y V t es el volumen a t o C entonces,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Aquí está la representación gráfica de la Ley de Charles:
Los globos aerostáticos funcionan sobre la base de la Ley de Charles. Cuando un quemador calienta el aire atrapado dentro del globo, las moléculas de aire comienzan a moverse más rápido y se expanden. El gas dentro del globo ocupa más espacio y se vuelve menos denso que el aire que lo rodea. A medida que el globo aerostático se vuelve menos denso, se eleva y flota.
Esto también se conoce como la Ley de Presión. Fue formulado por Joseph Louis Gay-Lussac en 1808.
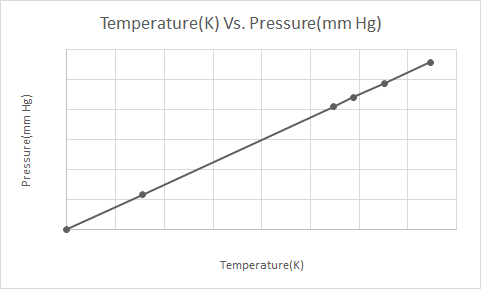
La Ley de Gay Lussac establece que, a volumen constante, la presión de un gas ideal es directamente proporcional a su temperatura absoluta (en Kelvin).
\(P ∝ T\)
\(P/T = k \)
donde
La Ley de Gay-Lussac se puede expresar como:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Donde:
De acuerdo con la Ley de Gay-Lussac, la presión de un gas (mantenido a volumen constante) se reduce constantemente a medida que se enfría hasta que el gas finalmente se condensa y se convierte en líquido.
Aquí está la representación gráfica de la Ley de Gay-Lussac
Cuando se calienta una lata de aerosol presurizada (por ejemplo, una lata de desodorante o una lata de pintura en aerosol), el aumento resultante de la presión ejercida por los gases sobre el recipiente puede provocar una explosión. Esta es la razón por la que muchos contenedores presurizados tienen etiquetas de advertencia que indican que el contenedor debe mantenerse alejado del fuego y almacenarse en un ambiente fresco.
Cuando se calienta una olla a presión, aumenta la presión que ejerce el vapor dentro del recipiente. La alta temperatura y presión dentro del recipiente hacen que los alimentos se cocinen más rápido.