سه قانون اساسی گاز (قانون بویل، قانون چارلز و قانون آووگادرو) وجود دارد که رابطه فشار، دما، حجم و مقدار گاز را توصیف می کند. در این درس به موارد زیر می پردازیم
این نام از رابرت بویل گرفته شده است.
این بیان میکند که وقتی دما و تعداد مولکولها ثابت هستند، حجم با فشار نسبت معکوس دارد.
\(P ∝ 1/V\)
\(P = k_1V\)
جایی که،
P فشار است
V حجم است
و k 1 ثابت تناسب است
حال اگر جرم ثابتی از گاز در دمای ثابت دچار انبساط شود، حجم و فشار نهایی باید P2 و V2 باشد.
حجم اولیه و فشار اولیه در اینجا P 1 و V 1 است، سپس طبق قانون بویل:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
بنابراین، در دمای ثابت، اگر فشار دو برابر شود، حجم آن گاز به نصف کاهش می یابد. در حالت آزاد، یک ماده گازی به دلیل وجود مولکول های پراکنده، حجم بیشتری از ظرف را اشغال می کند. هنگامی که فشار به ماده گازی وارد می شود، این مولکول ها نزدیک تر می شوند و حجم کمتری را اشغال می کنند. به عبارت دیگر فشار اعمال شده با چگالی گاز نسبت مستقیم دارد.
در اینجا نمایش گرافیکی قانون بویل است:
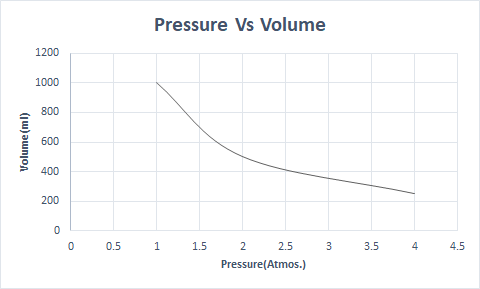
در ارتفاعات بالاتر، فشار اتمسفر کم است، بنابراین هوا چگالی کمتری دارد. در نتیجه، اکسیژن کمتری برای تنفس در دسترس است. این دلیلی است که کوهنوردان سیلندرهای اکسیژن حمل می کنند.
در سال 1787، ژاک چارلز تأثیر دما را بر حجم یک ماده گازی در فشار ثابت مطالعه کرد. قانون چارلز بیان می کند که در فشار ثابت و جرم ثابت، حجم گاز با دما نسبت مستقیم دارد.
\(V ∝ T\)
\(V = yT\)
جایی که y بسته به مقدار گاز و فشار ثابت است.
قانون چارلز به صورت زیر بیان می شود:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
این بدان معنی است که با افزایش دما، حجم افزایش می یابد. با کاهش دما، حجم کاهش می یابد. او در آزمایش خود محاسبه کرد که حجم یک جرم معین از یک گاز با هر درجه افزایش یا کاهش دما به ترتیب 1/273.15 برابر حجم اولیه افزایش یا کاهش می یابد.
بنابراین، اگر حجم V 0 در 0 O C باشد و V t حجم در t o C باشد،
\(V_t = V_0 + \frac{t}{273.15} V_0\)
در اینجا نمایش گرافیکی قانون چارلز است:
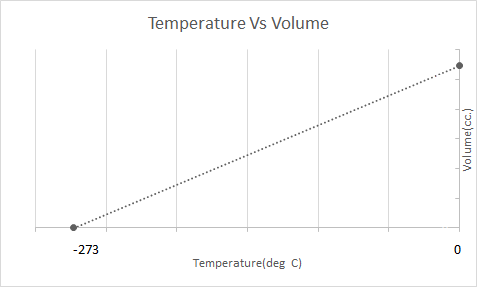
بالون های هوای گرم بر اساس قانون چارلز کار می کنند. هنگامی که مشعل هوای محبوس شده در داخل بالون را گرم می کند، مولکول های هوا سریعتر حرکت کرده و منبسط می شوند. گاز داخل بالون فضای بیشتری را اشغال می کند و نسبت به هوای اطراف آن چگالی کمتری دارد. با کاهش چگالی بالون هوای گرم، بالا میآید و شناور میشود.
این قانون به عنوان قانون فشار نیز شناخته می شود. توسط جوزف لوئیس گی لوساک در سال 1808 فرموله شد.
قانون گی لوساک بیان می کند که در حجم ثابت، فشار یک گاز ایده آل با دمای مطلق آن (به کلوین) نسبت مستقیم دارد.
\(P ∝ T\)
\(P/T = k \)
جایی که
قانون گی-لوساک را می توان به صورت زیر بیان کرد:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
جایی که:
بر اساس قانون گی-لوساک، فشار گاز (که در حجم ثابت نگه داشته میشود) با سرد شدن دائماً کاهش مییابد تا زمانی که گاز در نهایت متراکم شود و به مایع تبدیل شود.
در اینجا نمایش گرافیکی قانون گی-لوساک است
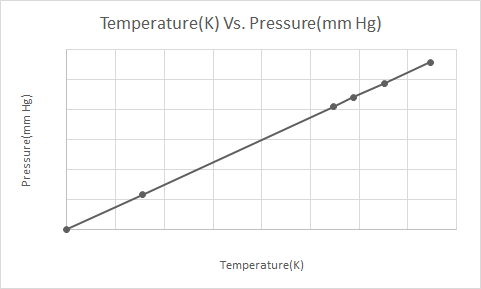
هنگامی که یک قوطی آئروسل تحت فشار (مثلاً قوطی دئودورانت یا قوطی رنگ اسپری) گرم می شود، افزایش فشار ناشی از گازهای روی ظرف می تواند منجر به انفجار شود. به همین دلیل است که بسیاری از ظروف تحت فشار دارای برچسب هشداری هستند که نشان می دهد ظروف باید دور از آتش و در محیط خنک نگهداری شود.
هنگامی که زودپز گرم می شود، فشار وارد شده توسط بخار داخل ظرف افزایش می یابد. دما و فشار زیاد داخل ظرف باعث می شود غذا سریعتر بپزد.