Il existe trois lois fondamentales sur les gaz (loi de Boyle, loi de Charles et loi d'Avogadro) qui décrivent la relation entre la pression, la température, le volume et la quantité de gaz. Dans cette leçon, nous aborderons les points suivants
Il porte le nom de Robert Boyle.
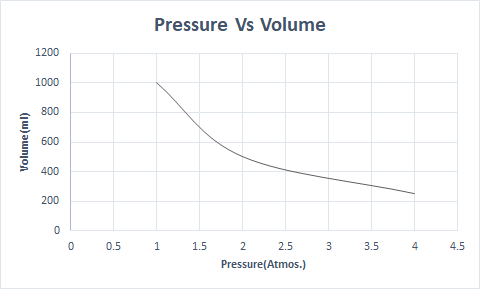
Cela indique que le volume est inversement proportionnel à la pression lorsque la température et le nombre de molécules sont constants.
\(P ∝ 1/V\)
\(P = k_1V\)
où,
P est la pression
V est le volume
et, k 1 est la constante de proportionnalité
Maintenant, si une masse fixe de gaz subit une expansion à température constante, alors le volume et la pression finaux seront P 2 et V 2 .
Le volume initial et la pression initiale sont ici P 1 et V 1 , puis selon la loi de Boyle :
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Ainsi, à température constante, si la pression est doublée, le volume de ce gaz est réduit de moitié. A l'état libre, une substance gazeuse occupe un plus grand volume du récipient en raison des molécules dispersées. Lorsqu'une pression est appliquée sur la substance gazeuse, ces molécules se rapprochent et occupent un volume moindre. En d'autres termes, la pression appliquée est directement proportionnelle à la densité du gaz.
Voici la représentation graphique de la loi de Boyle :
A plus haute altitude, la pression atmosphérique est basse donc l'air est moins dense. En conséquence, moins d'oxygène est disponible pour respirer. C'est la raison pour laquelle les alpinistes portent des bouteilles d'oxygène.
En 1787, Jacques Charles étudie l'effet de la température sur le volume d'une substance gazeuse à pression constante. La loi de Charles stipule qu'à pression et masse constantes, le volume d'un gaz est directement proportionnel à la température.
\(V ∝ T\)
\(V = yT\)
Où y est une constante dépendant de la quantité de gaz et de la pression.
La loi de Charles s'exprime par :
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
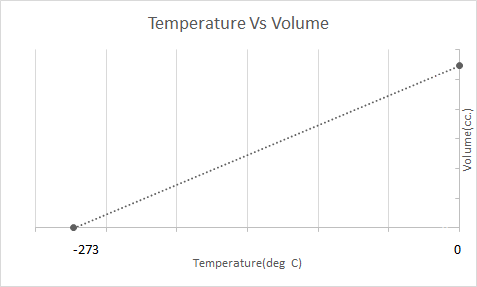
Cela signifie qu'avec l'augmentation de la température, le volume doit augmenter ; lorsque la température diminue, le volume diminue. Dans son expérience, il a calculé que le volume d'une masse donnée d'un gaz augmente ou diminue de 1/273,15 fois le volume d'origine à chaque degré d'augmentation ou de diminution de la température respectivement.
Par conséquent, si le volume est V 0 à 0 O C et V t est le volume à t o C alors,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Voici la représentation graphique de la loi de Charles :
Les montgolfières fonctionnent selon la loi de Charles. Lorsqu'un brûleur chauffe l'air emprisonné à l'intérieur du ballon, les molécules d'air commencent à se déplacer plus rapidement et se dilatent. Le gaz à l'intérieur du ballon prend plus de place, devenant moins dense que l'air qui l'entoure. Au fur et à mesure que la montgolfière devient moins dense, elle s'élève et flotte.
Ceci est également connu sous le nom de loi de pression. Elle a été formulée par Joseph Louis Gay-Lussac en 1808.
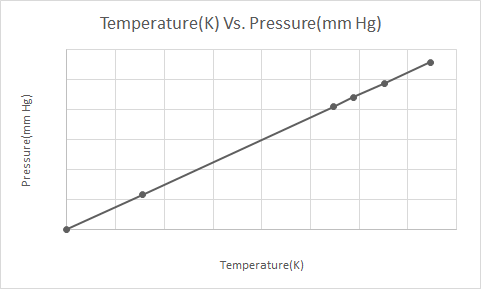
La loi de Gay Lussac stipule qu'à volume constant, la pression d'un gaz parfait est directement proportionnelle à sa température absolue (en Kelvin).
\(P ∝ T\)
\(P/T = k \)
où
La loi de Gay-Lussac peut être exprimée comme suit :
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Où:
Selon la loi de Gay-Lussac, la pression d'un gaz (maintenu à volume constant) diminue constamment à mesure qu'il se refroidit jusqu'à ce que le gaz finisse par se condenser et devienne liquide.
Voici la représentation graphique de la loi de Gay-Lussac
Lorsqu'une bombe aérosol sous pression (par exemple une bombe de déodorant ou une bombe de peinture en aérosol) est chauffée, l'augmentation résultante de la pression exercée par les gaz sur le récipient peut provoquer une explosion. C'est la raison pour laquelle de nombreux récipients sous pression portent des étiquettes d'avertissement indiquant que le récipient doit être tenu à l'écart du feu et stocké dans un environnement frais.
Lorsqu'un autocuiseur est chauffé, la pression exercée par la vapeur à l'intérieur du récipient augmente. La température et la pression élevées à l'intérieur du récipient accélèrent la cuisson des aliments.