तीन मूलभूत गैस नियम हैं (बॉयल का नियम, चार्ल्स का नियम और अवोगाद्रो का नियम) जो गैस के दबाव, तापमान, आयतन और मात्रा के संबंध का वर्णन करता है। इस पाठ में, हम निम्नलिखित पर चर्चा करेंगे
इसका नाम रॉबर्ट बॉयल के नाम पर रखा गया है।
यह बताता है कि तापमान और अणुओं की संख्या स्थिर होने पर आयतन दबाव के व्युत्क्रमानुपाती होता है।
\(P ∝ 1/V\)
\(P = k_1V\)
कहाँ पे,
पी दबाव है
वी वॉल्यूम है
और, k , समानुपाती नियतांक है
अब, यदि गैस के एक निश्चित द्रव्यमान का स्थिर तापमान पर विस्तार होता है तो अंतिम आयतन और दबाव P2 और V2 होंगे।
यहाँ प्रारंभिक आयतन और प्रारंभिक दबाव P1 और V 1 है , तो बॉयल के नियम के अनुसार:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
इस प्रकार, एक स्थिर तापमान पर, यदि दबाव दोगुना कर दिया जाता है, तो उस गैस का आयतन घटकर आधा रह जाता है। एक मुक्त अवस्था में, बिखरे हुए अणुओं के कारण एक गैसीय पदार्थ कंटेनर की एक बड़ी मात्रा में रहता है। जब गैसीय पदार्थ पर दबाव डाला जाता है, तो ये अणु करीब आ जाते हैं और कम मात्रा में कब्जा कर लेते हैं। दूसरे शब्दों में, लगाया गया दबाव गैस के घनत्व के सीधे आनुपातिक होता है।
यहाँ बॉयल के नियम का चित्रमय प्रतिनिधित्व है:
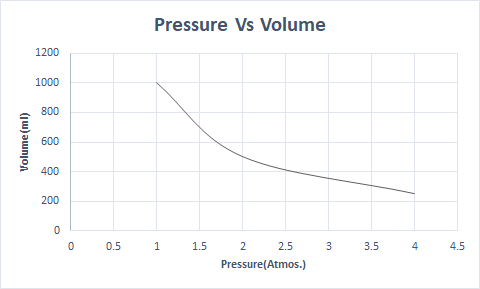
अधिक ऊंचाई पर, वायुमंडलीय दबाव कम होता है इसलिए हवा कम घनी होती है। नतीजतन, सांस लेने के लिए कम ऑक्सीजन उपलब्ध है। यही कारण है कि पर्वतारोही ऑक्सीजन सिलेंडर लेकर चलते हैं।
1787 में, जैक्स चार्ल्स ने एक स्थिर दबाव पर गैसीय पदार्थ के आयतन पर तापमान के प्रभाव का अध्ययन किया। चार्ल्स का नियम कहता है कि स्थिर दबाव और स्थिर द्रव्यमान पर, गैस का आयतन तापमान के सीधे आनुपातिक होता है।
\(V ∝ T\)
\(V = yT\)
जहां y गैस और दबाव की मात्रा के आधार पर एक स्थिरांक है।
चार्ल्स का नियम इस प्रकार व्यक्त किया जाता है:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
इसका मतलब है कि तापमान में वृद्धि के साथ मात्रा में वृद्धि होगी; घटते तापमान के साथ, मात्रा घट जाती है। अपने प्रयोग में, उन्होंने गणना की कि किसी गैस के दिए गए द्रव्यमान का आयतन तापमान में क्रमशः प्रत्येक डिग्री वृद्धि या गिरावट के साथ मूल आयतन का 1/273.15 गुना बढ़ता या घटता है।
इसलिए, यदि आयतन 0 O C पर V 0 है और V t , t o C पर आयतन है, तो,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
यहाँ चार्ल्स के नियम का चित्रमय प्रतिनिधित्व है:
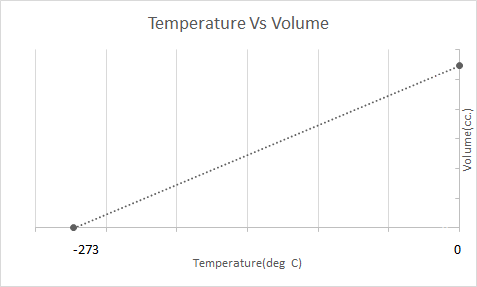
गर्म हवा के गुब्बारे चार्ल्स के नियम के आधार पर काम करते हैं। जब एक बर्नर गुब्बारे के अंदर फंसी हवा को गर्म करता है, तो हवा के अणु तेजी से बढ़ने लगते हैं और फैल जाते हैं। गुब्बारे के अंदर की गैस अधिक जगह घेरती है, उसके आसपास की हवा की तुलना में कम घनी हो जाती है। जैसे ही गर्म हवा का गुब्बारा कम घना हो जाता है, यह ऊपर उठता है और तैरता है।
इसे दबाव कानून के रूप में भी जाना जाता है। इसे 1808 में जोसेफ लुइस गे-लुसाक द्वारा तैयार किया गया था।
गे लुसाक का नियम कहता है कि स्थिर आयतन पर, एक आदर्श गैस का दबाव उसके निरपेक्ष तापमान (केल्विन में) के सीधे आनुपातिक होता है।
\(P ∝ T\)
\(P/T = k \)
कहाँ पे
गे-लुसाक के नियम को इस प्रकार व्यक्त किया जा सकता है:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
कहाँ पे:
गे-लुसाक के नियम के अनुसार, गैस का दबाव (स्थिर आयतन पर रखा जाता है) लगातार कम होता जाता है क्योंकि इसे तब तक ठंडा किया जाता है जब तक कि गैस अंततः संघनन से होकर तरल न हो जाए।
यहाँ गे-लुसाक के नियम का चित्रमय प्रतिनिधित्व है
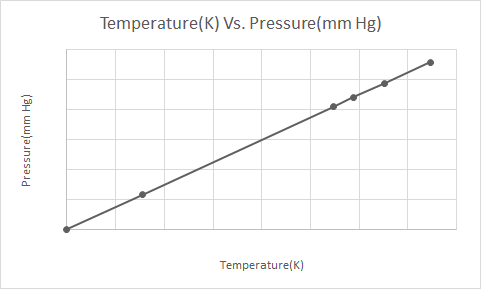
जब एक प्रेशराइज्ड एरोसोल कैन (जैसे डिओडोरेंट कैन या स्प्रे-पेंट कैन) को गर्म किया जाता है, तो कंटेनर पर गैसों द्वारा लगाए गए दबाव में परिणामी वृद्धि के परिणामस्वरूप विस्फोट हो सकता है। यही कारण है कि कई दबाव वाले कंटेनरों में चेतावनी लेबल होते हैं जो बताते हैं कि कंटेनर को आग से दूर रखा जाना चाहिए और ठंडे वातावरण में संग्रहित किया जाना चाहिए।
जब एक प्रेशर कुकर को गर्म किया जाता है, तो कंटेनर के अंदर भाप द्वारा डाला गया दबाव बढ़ जाता है। कंटेनर के अंदर उच्च तापमान और दबाव के कारण भोजन तेजी से पकता है।