Postoje tri temeljna plinska zakona (Boyleov zakon, Charlesov zakon i Avogadrov zakon) koji opisuju odnos tlaka, temperature, volumena i količine plina. U ovoj lekciji razgovarat ćemo o sljedećem
Ime je dobio po Robertu Boyleu.
To kaže da je volumen obrnuto proporcionalan tlaku kada su temperatura i broj molekula konstantni.
\(P ∝ 1/V\)
\(P = k_1V\)
gdje,
P je tlak
V je volumen
i k 1 je konstanta proporcionalnosti
Sada, ako fiksna masa plina prolazi kroz ekspanziju pri konstantnoj temperaturi, tada će konačni volumen i tlak biti P 2 i V 2 .
Početni volumen i početni tlak ovdje su P 1 i V 1 , tada prema Boyleovom zakonu:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
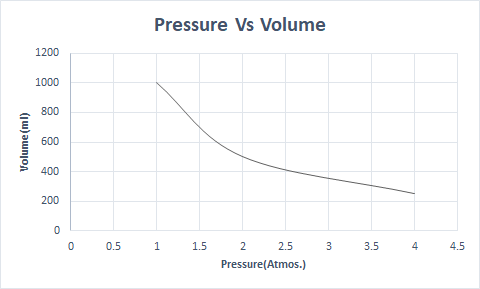
Dakle, pri konstantnoj temperaturi, ako se tlak udvostruči, volumen tog plina se smanjuje na pola. U slobodnom stanju plinovita tvar zauzima veći volumen posude zbog raspršenih molekula. Kada se tlak primijeni na plinovitu tvar, te se molekule približavaju i zauzimaju manji volumen. Drugim riječima, primijenjeni tlak izravno je proporcionalan gustoći plina.
Ovdje je grafički prikaz Boyleovog zakona:
Na većoj nadmorskoj visini, atmosferski tlak je nizak pa je zrak manje gust. Kao rezultat, manje kisika je dostupno za disanje. To je razlog zašto planinari nose boce s kisikom.
Godine 1787. Jacques Charles proučavao je utjecaj temperature na volumen plinovite tvari pri konstantnom tlaku. Charlesov zakon kaže da je pri konstantnom tlaku i konstantnoj masi volumen plina izravno proporcionalan temperaturi.
\(V ∝ T\)
\(V = yT\)
Gdje je y konstanta ovisno o količini plina i tlaku.
Charlesov zakon se izražava kao:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
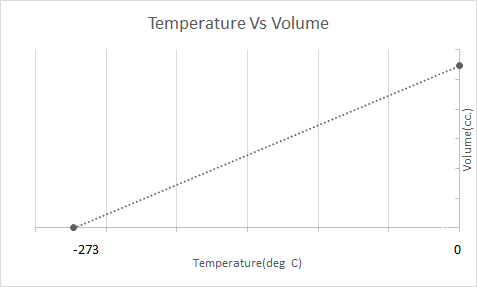
To znači da će se povećanjem temperature volumen povećati; s padom temperature, volumen se smanjuje. U svom eksperimentu izračunao je da se volumen dane mase plina povećava ili smanjuje za 1/273,15 puta izvornog volumena sa svakim porastom ili padom temperature svakim stupnjem.
Stoga, ako je volumen V 0 na 0 O C i V t je volumen na t o C, tada,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Ovdje je grafički prikaz Karlovog zakona:
Baloni na vrući zrak rade na temelju Charlesovog zakona. Kada plamenik zagrije zrak zarobljen unutar balona, molekule zraka počinju se kretati brže i šire se. Plin unutar balona zauzima više prostora, postajući manje gust od zraka koji ga okružuje. Kako balon vrućeg zraka postaje manje gust, on se diže i pluta.
Ovo je također poznato kao Zakon o pritisku. Formulirao ga je Joseph Louis Gay-Lussac 1808. godine.
Gay Lussacov zakon kaže da je pri konstantnom volumenu tlak idealnog plina izravno proporcionalan njegovoj apsolutnoj temperaturi (u Kelvinima).
\(P ∝ T\)
\(P/T = k \)
gdje
Gay-Lussacov zakon se može izraziti kao:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Gdje:
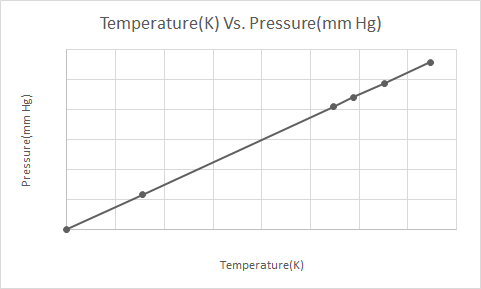
Prema Gay-Lussacovom zakonu, tlak plina (koja se održava na konstantnom volumenu) stalno se smanjuje dok se hladi sve dok plin na kraju ne podliježe kondenzaciji i postane tekućina.
Ovdje je grafički prikaz Gay-Lussacovog zakona
Kada se aerosolna limenka pod tlakom (npr. limenka za dezodorans ili limenka s bojom u spreju) zagrije, rezultirajuće povećanje tlaka koji plinovi vrše na spremnik može rezultirati eksplozijom. To je razlog zašto mnogi spremnici pod tlakom imaju naljepnice upozorenja da se spremnik mora čuvati podalje od vatre i pohraniti u hladnom okruženju.
Kada se ekspres lonac zagrije, povećava se pritisak pare unutar posude. Visoka temperatura i pritisak unutar posude uzrokuju brže kuhanje hrane.