Ada tiga hukum dasar gas (Hukum Boyle, Hukum Charles, dan Hukum Avogadro) yang menjelaskan hubungan tekanan, suhu, volume, dan jumlah gas. Dalam pelajaran ini, kita akan membahas hal berikut
Itu dinamai Robert Boyle.
Ini menyatakan bahwa volume berbanding terbalik dengan tekanan ketika suhu dan jumlah molekul konstan.
\(P ∝ 1/V\)
\(P = k_1V\)
Di mana,
P adalah tekanan
V adalah Volume
dan, k 1 adalah konstanta proporsionalitas
Sekarang, jika massa tetap gas mengalami pemuaian pada suhu konstan maka volume dan tekanan akhir akan menjadi P 2 dan V 2 .
Volume awal dan tekanan awal disini adalah P 1 dan V 1 , maka menurut hukum Boyle :
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Jadi, pada suhu konstan, jika tekanannya digandakan, volume gas itu berkurang menjadi setengahnya. Dalam keadaan bebas, zat gas menempati volume wadah yang lebih besar karena molekul yang tersebar. Ketika tekanan diterapkan pada zat gas, molekul-molekul ini mendekat dan menempati volume yang lebih kecil. Dengan kata lain, tekanan yang diterapkan berbanding lurus dengan kerapatan gas.
Berikut adalah representasi grafis dari Hukum Boyle:
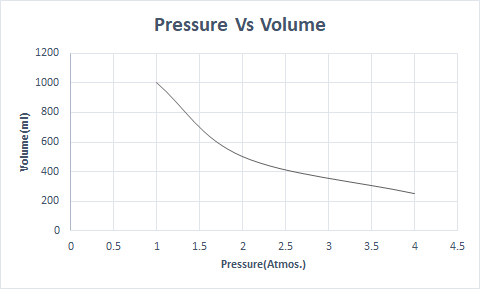
Pada ketinggian yang lebih tinggi, tekanan atmosfer rendah sehingga udara kurang padat. Akibatnya, lebih sedikit oksigen yang tersedia untuk bernafas. Inilah alasan pendaki gunung membawa tabung oksigen.
Pada tahun 1787, Jacques Charles mempelajari pengaruh suhu terhadap volume zat gas pada tekanan tetap. Hukum Charles menyatakan bahwa pada tekanan konstan dan massa konstan, volume gas berbanding lurus dengan suhu.
\(V ∝ T\)
\(V = yT\)
Dimana y adalah konstanta tergantung pada jumlah gas dan tekanan.
Hukum Charles dinyatakan sebagai:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Ini berarti bahwa dengan kenaikan suhu, volumenya akan bertambah; dengan penurunan suhu, volume berkurang. Dalam eksperimennya, ia menghitung bahwa volume suatu massa gas tertentu bertambah atau berkurang sebesar 1/273,15 kali volume aslinya dengan setiap derajat kenaikan atau penurunan suhu.
Oleh karena itu, jika volume adalah V 0 pada 0 O C dan V t adalah volume pada t o C, maka,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Berikut adalah representasi grafis dari Hukum Charles:
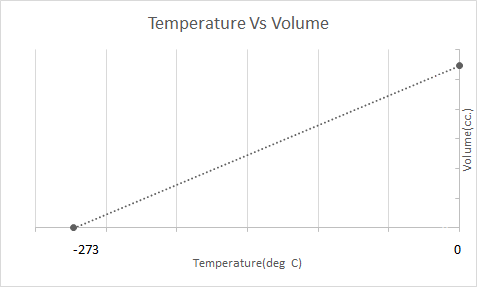
Balon udara bekerja berdasarkan Hukum Charles. Saat pembakar memanaskan udara yang terperangkap di dalam balon, molekul udara mulai bergerak lebih cepat dan mengembang. Gas di dalam balon memakan lebih banyak ruang, menjadi kurang padat dibandingkan udara di sekitarnya. Saat balon udara menjadi kurang padat, ia naik dan mengapung.
Ini juga dikenal sebagai Hukum Tekanan. Itu dirumuskan oleh Joseph Louis Gay-Lussac pada tahun 1808.
Hukum Gay Lussac menyatakan bahwa pada volume konstan, tekanan gas ideal berbanding lurus dengan suhu absolutnya (dalam Kelvin).
\(P ∝ T\)
\(P/T = k \)
Di mana
Hukum Gay-Lussac dapat dinyatakan sebagai:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Di mana:
Menurut Hukum Gay-Lussac, tekanan gas (dipertahankan pada volume konstan) berkurang secara konstan saat didinginkan hingga gas akhirnya mengalami kondensasi dan menjadi cair.
Inilah representasi grafis dari Hukum Gay-Lussac
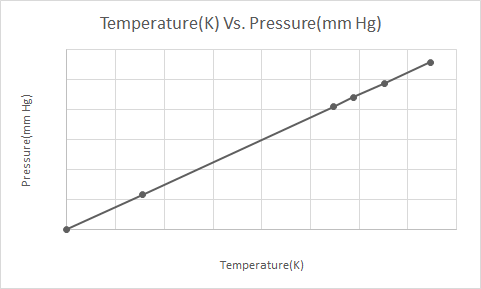
Ketika kaleng aerosol bertekanan (misalnya kaleng deodoran atau kaleng cat semprot) dipanaskan, peningkatan tekanan yang dihasilkan oleh gas pada wadah dapat menyebabkan ledakan. Inilah alasan mengapa banyak wadah bertekanan memiliki label peringatan yang menyatakan bahwa wadah harus dijauhkan dari api dan disimpan di lingkungan yang sejuk.
Saat pressure cooker dipanaskan, tekanan yang diberikan oleh uap di dalam wadah meningkat. Suhu dan tekanan yang tinggi di dalam wadah menyebabkan makanan lebih cepat matang.