Esistono tre leggi fondamentali sui gas (legge di Boyle, legge di Charles e legge di Avogadro) che descrivono la relazione tra pressione, temperatura, volume e quantità di gas. In questa lezione, discuteremo quanto segue
Prende il nome da Robert Boyle.
Ciò afferma che il volume è inversamente proporzionale alla pressione quando la temperatura e il numero di molecole sono costanti.
\(P ∝ 1/V\)
\(P = k_1V\)
dove,
P è la pressione
V è il Volume
e, k 1 è la costante di proporzionalità
Ora, se una massa fissa di gas subisce un'espansione a temperatura costante, allora il volume e la pressione finali saranno P 2 e V 2 .
Il volume iniziale e la pressione iniziale qui sono P 1 e V 1 , quindi secondo la legge di Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Così, a temperatura costante, se la pressione raddoppia, il volume di quel gas si riduce della metà. Allo stato libero, una sostanza gassosa occupa un volume maggiore del contenitore a causa delle molecole disperse. Quando la pressione viene applicata alla sostanza gassosa, queste molecole si avvicinano e occupano un volume minore. In altre parole, la pressione applicata è direttamente proporzionale alla densità del gas.
Ecco la rappresentazione grafica della legge di Boyle:
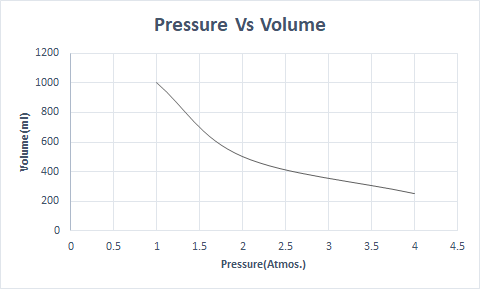
A quote più elevate, la pressione atmosferica è bassa, quindi l'aria è meno densa. Di conseguenza, è disponibile meno ossigeno per la respirazione. Questo è il motivo per cui gli alpinisti portano bombole di ossigeno.
Nel 1787 Jacques Charles studiò l'effetto della temperatura sul volume di una sostanza gassosa a pressione costante. La legge di Charles afferma che a pressione costante e massa costante, il volume di un gas è direttamente proporzionale alla temperatura.
\(V ∝ T\)
\(V = yT\)
Dove y è una costante che dipende dalla quantità di gas e dalla pressione.
La legge di Charles si esprime come:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Ciò significa che con l'aumentare della temperatura il volume aumenterà; con la diminuzione della temperatura, il volume diminuisce. Nel suo esperimento, ha calcolato che il volume di una data massa di un gas aumenta o diminuisce di 1/273,15 volte rispetto al volume originale rispettivamente per ogni grado di aumento o diminuzione della temperatura.
Pertanto, se il volume è V 0 a 0 O C e V t è il volume a t o C allora,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Ecco la rappresentazione grafica della legge di Charles:
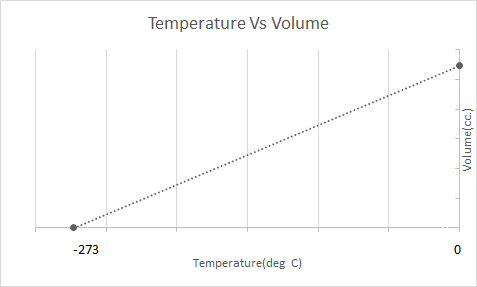
Le mongolfiere funzionano sulla base della legge di Charles. Quando un bruciatore riscalda l'aria intrappolata all'interno del pallone, le molecole d'aria iniziano a muoversi più velocemente e si espandono. Il gas all'interno del pallone occupa più spazio, diventando meno denso dell'aria che lo circonda. Man mano che la mongolfiera diventa meno densa, si alza e galleggia.
Questo è anche noto come la legge della pressione. Fu formulato da Joseph Louis Gay-Lussac nel 1808.
La legge di Gay Lussac afferma che a volume costante, la pressione di un gas ideale è direttamente proporzionale alla sua temperatura assoluta (in Kelvin).
\(P ∝ T\)
\(P/T = k \)
dove
La legge di Gay-Lussac può essere espressa come:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Dove:
Secondo la legge di Gay-Lussac, la pressione di un gas (mantenuto a volume costante) si riduce costantemente man mano che viene raffreddato fino a quando il gas alla fine subisce la condensazione e diventa un liquido.
Ecco la rappresentazione grafica della legge di Gay-Lussac
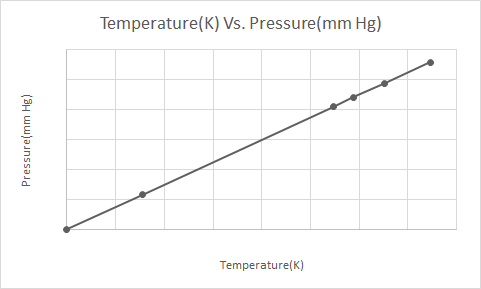
Quando una bomboletta aerosol pressurizzata (ad es. bomboletta di deodorante o bomboletta di vernice spray) viene riscaldata, il conseguente aumento della pressione esercitata dai gas sul contenitore può provocare un'esplosione. Questo è il motivo per cui molti contenitori pressurizzati hanno etichette di avvertenza che affermano che il contenitore deve essere tenuto lontano dal fuoco e conservato in un ambiente fresco.
Quando una pentola a pressione viene riscaldata, la pressione esercitata dal vapore all'interno del recipiente aumenta. L'alta temperatura e la pressione all'interno del contenitore fanno sì che il cibo cuocia più velocemente.