気体の圧力、温度、体積、量の関係を説明する 3 つの基本的な気体の法則 (ボイルの法則、シャルルの法則、アボガドロの法則) があります。このレッスンでは、次のことについて説明します。
ロバート・ボイルにちなんで名付けられました。
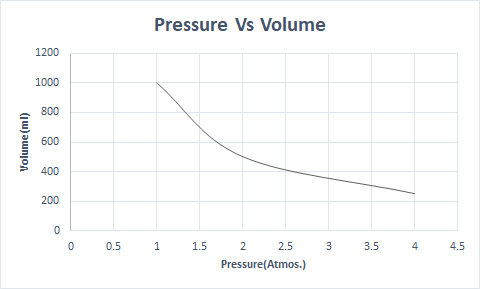
これは、温度と分子数が一定の場合、体積は圧力に反比例することを示しています。
\(P ∝ 1/V\)
\(P = k_1V\)
どこ、
P は圧力
Vはボリュームです
k 1は比例定数です。
ここで、固定質量の気体が一定温度で膨張すると、最終的な体積と圧力は P 2と V 2になります。
ここでの初期体積と初期圧力は P 1と V 1であり、ボイルの法則に従います。
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
したがって、一定の温度で圧力が 2 倍になると、その気体の体積は半分になります。自由な状態では、ガス状物質は、散乱した分子のために容器のより大きな体積を占めます。気体物質に圧力がかかると、これらの分子は接近し、占める体積が小さくなります。言い換えれば、適用される圧力は、ガスの密度に正比例します。
ボイルの法則をグラフにすると次のようになります。
高度が高いと大気圧が低くなるため、空気の密度が低くなります。その結果、呼吸に利用できる酸素が少なくなります。これが、登山家が酸素ボンベを運ぶ理由です。
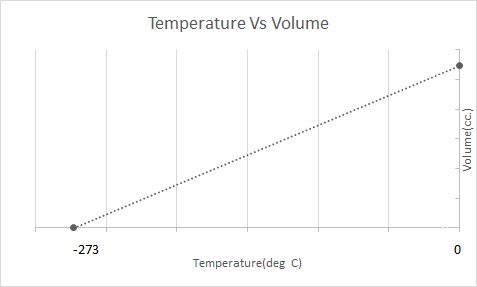
1787 年、ジャック シャルルは、一定の圧力下にあるガス状物質の体積に対する温度の影響を研究しました。シャルルの法則は、一定の圧力と一定の質量では、気体の体積は温度に正比例すると述べています。
\(V ∝ T\)
\(V = yT\)
ここで、y はガスの量と圧力に応じた定数です。
シャルルの法則は次のように表されます。
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
これは、温度が上昇すると体積が増加することを意味します。温度が下がると、体積が減少します。彼の実験では、彼は、与えられた質量のガスの体積が、温度がそれぞれ1度上昇または低下するごとに、元の体積の1/273.15倍増加または減少することを計算しました。
したがって、体積が 0 ℃での V 0で、V tが℃での体積である場合、
\(V_t = V_0 + \frac{t}{273.15} V_0\)
シャルルの法則をグラフにすると次のようになります。
熱気球はシャルルの法則に基づいて作動します。風船の中に閉じ込められた空気をバーナーで加熱すると、空気分子がより速く動き始め、膨張します。気球内の気体は、周囲の空気よりも密度が低くなり、より多くのスペースを占有します。熱気球の密度が低くなると、上昇して浮きます。
これは、圧力の法則としても知られています。 1808年にジョゼフ・ルイ・ゲイ=リュサックによって策定されました。
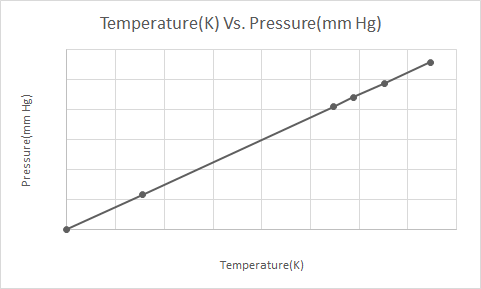
ゲイ リュサックの法則では、体積が一定の場合、理想気体の圧力はその絶対温度 (ケルビン単位) に正比例します。
\(P ∝ T\)
\(P/T = k \)
どこ
ゲイ・リュサックの法則は次のように表現できます。
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
どこ:
ゲイ・リュサックの法則によれば、一定の体積に保たれている気体の圧力は、気体が最終的に凝縮して液体になるまで、冷却されるにつれて絶えず低下します。
これは、ゲイ・リュサックの法則のグラフ表示です
加圧されたエアゾール缶(消臭剤の缶やスプレー塗料の缶など)が加熱されると、ガスによって容器にかかる圧力が上昇し、爆発が発生する可能性があります。これが、多くの加圧容器に、容器を火気から遠ざけ、涼しい環境に保管する必要があることを示す警告ラベルが貼られている理由です。
圧力鍋を加熱すると、容器内の蒸気による圧力が高まります。容器内の高温と高圧により、食品はより速く調理されます。