Постојат три основни закони за гас (Бојлов закон, Чарлсов закон и Авогадро) кои ја опишуваат врската на притисокот, температурата, волуменот и количината на гасот. Во оваа лекција, ќе разговараме за следново
Името го носи по Роберт Бојл.
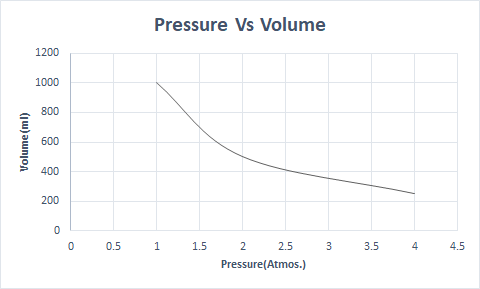
Ова наведува дека волуменот е обратно пропорционален на притисокот кога температурата и бројот на молекули се константни.
\(P ∝ 1/V\)
\(P = k_1V\)
каде,
P е притисокот
V е волуменот
и, k 1 е константа на пропорционалност
Сега, ако фиксна маса на гас подлежи на експанзија при константна температура, тогаш конечниот волумен и притисок ќе бидат P 2 и V 2 .
Почетниот волумен и почетниот притисок овде се P 1 и V 1 , тогаш според Бојловиот закон:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Така, при константна температура, ако притисокот се удвои, волуменот на тој гас се намалува на половина. Во слободна состојба, гасовитата супстанција зафаќа поголем волумен од садот поради расфрланите молекули. Кога се применува притисок на гасовитата супстанција, овие молекули се приближуваат и заземаат помал волумен. Со други зборови, применетиот притисок е директно пропорционален на густината на гасот.
Еве го графичкиот приказ на Бојловиот закон:
На поголема надморска височина, атмосферскиот притисок е низок, така што воздухот е помалку густ. Како резултат на тоа, помалку кислород е достапен за дишење. Ова е причината поради која планинарите носат боци со кислород.
Во 1787 година, Жак Шарл го проучувал ефектот на температурата врз волуменот на гасовита супстанција при постојан притисок. Чарлсовиот закон вели дека при постојан притисок и константна маса, волуменот на гасот е директно пропорционален на температурата.
\(V ∝ T\)
\(V = yT\)
Каде што y е константа во зависност од количината на гас и притисок.
Законот на Чарлс е изразен како:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
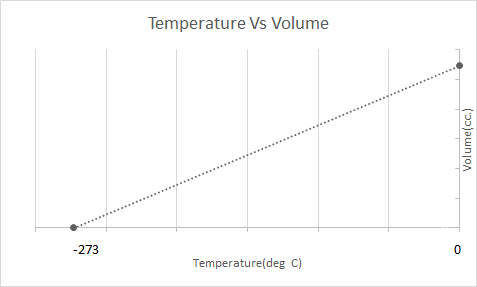
Тоа значи дека со зголемувањето на температурата волуменот ќе се зголемува; со намалување на температурата, волуменот се намалува. Во својот експеримент, тој пресметал дека волуменот на дадена маса на гас се зголемува или намалува за 1/273,15 пати од првичниот волумен со секој степен пораст или пад на температурата соодветно.
Затоа, ако волуменот е V 0 на 0 O C и V t е волуменот на t o C тогаш,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Еве го графичкиот приказ на законот на Чарлс:
Балоните со топол воздух работат врз основа на законот на Чарлс. Кога горилникот го загрева воздухот заробен во балонот, молекулите на воздухот почнуваат да се движат побрзо и се шират. Гасот во балонот зазема повеќе простор, станувајќи помалку густ од воздухот што го опкружува. Како што балонот со топол воздух станува помалку густ, тој се крева и лебди.
Ова е познато и како Закон за притисок. Формулиран е од Џозеф Луис Геј-Лусак во 1808 година.
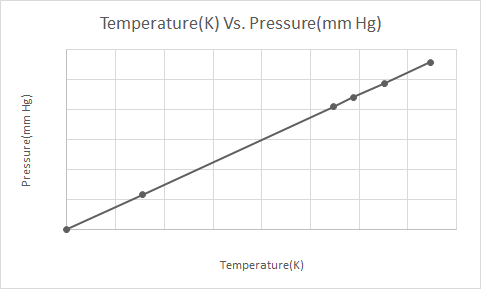
Законот на Геј Лусак вели дека при постојан волумен, притисокот на идеалниот гас е директно пропорционален на неговата апсолутна температура (во Келвин).
\(P ∝ T\)
\(P/T = k \)
каде
Законот на Геј-Лусак може да се изрази како:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Каде:
Според законот на Геј-Лусак, притисокот на гасот (чуван на константен волумен) постојано се намалува додека се лади додека гасот на крајот не претрпи кондензација и не стане течност.
Еве го графичкиот приказ на законот на Геј-Лусак
Кога ќе се загрее лименката за аеросол под притисок (на пр. конзерва со дезодоранси или конзерва со боја за прскање), како резултат на зголемување на притисокот што го вршат гасовите врз контејнерот може да дојде до експлозија. Ова е причината зошто многу контејнери под притисок имаат етикети за предупредување дека садот мора да се чува подалеку од оган и да се чува во ладна средина.
Кога шпоретот под притисок се загрева, притисокот што го врши пареата внатре во садот се зголемува. Високата температура и притисокот во садот предизвикуваат храната да се готви побрзо.