Хийн даралт, температур, эзэлхүүн, хэмжээ хоорондын хамаарлыг тодорхойлдог хийн гурван үндсэн хууль (Бойлын хууль, Чарльзын хууль, Авогадрогийн хууль) байдаг. Энэ хичээлээр бид дараахь зүйлийг хэлэлцэх болно
Энэ нь Роберт Бойлийн нэрээр нэрлэгдсэн.
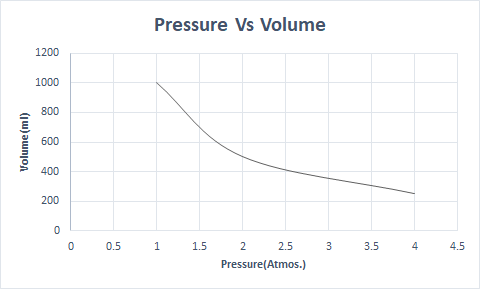
Энэ нь температур ба молекулын тоо тогтмол байх үед эзэлхүүн нь даралттай урвуу хамааралтай болохыг харуулж байна.
\(P ∝ 1/V\)
\(P = k_1V\)
хаана,
P нь даралт юм
V нь эзлэхүүн юм
ба, k 1 нь пропорционалын тогтмол юм
Хэрэв хийн тогтмол масс тогтмол температурт тэлэлтэнд өртвөл эцсийн эзэлхүүн ба даралт нь P 2 ба V 2 байна.
Энд байгаа анхны эзэлхүүн ба анхны даралт нь P 1 ба V 1 , дараа нь Бойлийн хуулийн дагуу:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Тиймээс тогтмол температурт даралтыг хоёр дахин нэмэгдүүлбэл тэр хийн эзэлхүүн хагас хүртэл буурдаг. Чөлөөт төлөвт хийн бодис нь тараагдсан молекулуудын улмаас илүү их хэмжээний савыг эзэлдэг. Хийн бодисыг дарах үед эдгээр молекулууд ойртож, бага эзэлхүүнийг эзэлдэг. Өөрөөр хэлбэл, хэрэглэж буй даралт нь хийн нягттай шууд пропорциональ байна.
Бойлийн хуулийн график дүрслэлийг энд үзүүлэв.
Өндөрт атмосферийн даралт бага байдаг тул агаарын нягт бага байдаг. Үүний үр дүнд амьсгалахад хүчилтөрөгч бага байдаг. Энэ нь уулчид хүчилтөрөгчийн баллон авч явдаг шалтгаан юм.
1787 онд Жак Чарльз тогтмол даралттай хийн бодисын эзлэхүүн дэх температурын нөлөөг судалжээ. Чарльзын хуульд тогтмол даралт, тогтмол масстай үед хийн эзэлхүүн нь температуртай шууд пропорциональ байна гэж заасан байдаг.
\(V ∝ T\)
\(V = yT\)
Энд y нь хийн хэмжээ ба даралтын хэмжээнээс хамаарч тогтмол байна.
Чарльзын хуулийг дараах байдлаар илэрхийлнэ.
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
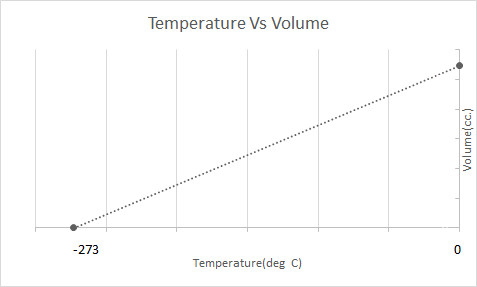
Энэ нь температур нэмэгдэхийн хэрээр эзлэхүүн нэмэгдэх болно гэсэн үг юм; температур буурах тусам эзлэхүүн буурдаг. Тэрээр туршилтдаа хийн өгөгдсөн массын эзэлхүүн нь температурын өсөлт, бууралт бүрд анхны эзэлхүүнээс 1/273.15 дахин ихэсдэг эсвэл багасдаг болохыг тооцоолсон.
Иймд, хэрэв 0 O C-ийн эзлэхүүн нь V 0 , V t нь t o C-ийн эзэлхүүн байвал,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Чарльзын хуулийн график дүрслэлийг энд үзүүлэв.
Халуун агаарын бөмбөлөг Чарльзын хуулийн үндсэн дээр ажилладаг. Шатаагч нь бөмбөлөг дотор байгаа агаарыг халаахад агаарын молекулууд илүү хурдан хөдөлж, өргөжиж эхэлдэг. Бөмбөлөг доторх хий нь илүү их зай эзэлдэг тул түүнийг хүрээлэн буй агаараас бага нягт болдог. Халуун агаарын бөмбөлөг нягт багасах тусам дээшээ хөөрч хөвдөг.
Үүнийг Даралтын хууль ч гэж нэрлэдэг. Үүнийг 1808 онд Жозеф Луис Гэй-Люссак боловсруулсан.
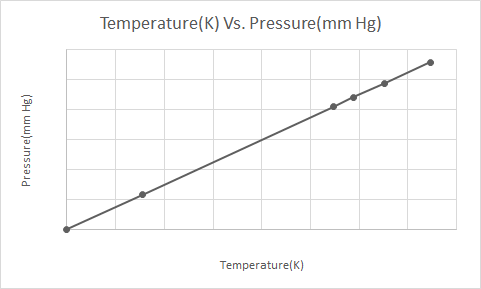
Гэй Луссакийн хууль нь тогтмол эзэлхүүнтэй үед идеал хийн даралт нь түүний үнэмлэхүй температуртай (Кельвин) шууд пропорциональ байна гэж заасан байдаг.
\(P ∝ T\)
\(P/T = k \)
хаана
Гей-Луссакийн хуулийг дараах байдлаар илэрхийлж болно.
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Хаана:
Гэй-Люссакийн хуулийн дагуу хийн даралт (тогтмол эзэлхүүнтэй) хөргөх үед хий нь конденсацад орж шингэн болох хүртэл байнга буурдаг.
Гэй-Люссакийн хуулийн график дүрслэлийг энд үзүүлэв
Даралттай аэрозолийн савыг (жишээ нь үнэр дарагч эсвэл шүршигч будгийн сав) халаахад саван дээрх хийн даралт ихсэх нь дэлбэрэлт үүсгэж болзошгүй. Энэ нь олон даралтат саванд савыг галаас хол байлгаж, сэрүүн орчинд хадгалахыг анхааруулсан шошготой байдаг шалтгаан юм.
Даралт агшаагчийг халаахад савны доторх уурын даралт нэмэгддэг. Савны доторх өндөр температур, даралт нь хоолыг хурдан чанахад хүргэдэг.