ဖိအား၊ အပူချိန်၊ ထုထည်နှင့် ဓာတ်ငွေ့ပမာဏတို့၏ ဆက်နွယ်မှုကို ဖော်ပြသော အခြေခံဓာတ်ငွေ့ဥပဒေ (Boyle's Law၊ Charles' Law နှင့် Avogadro's Law) သုံးခုရှိသည်။ ဤသင်ခန်းစာတွင် အောက်ပါတို့ကို ဆွေးနွေးပါမည်။
Robert Boyle ၏အမည်ကိုအစွဲပြုသည်။
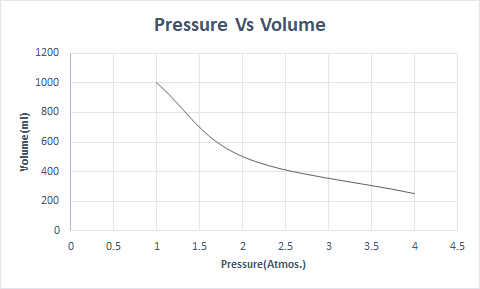
၎င်းသည် အပူချိန်နှင့် မော်လီကျူးအရေအတွက် မတည်မြဲသည့်အခါ ထုထည်သည် ဖိအားနှင့် ပြောင်းပြန်အချိုးကျသည်ဟု ဖော်ပြထားသည်။
\(P ∝ 1/V\)
\(P = k_1V\)
ဘယ်မှာလဲ၊
P သည် ဖိအားဖြစ်သည်။
V သည် Volume ဖြစ်သည်။
k 1 သည် အချိုးကျ ကိန်းသေဖြစ်သည်။
ယခု၊ ပုံသေဓာတ်ငွေ့တစ်ခုသည် အဆက်မပြတ်အပူချိန်တွင် ချဲ့ထွင်လာပါက နောက်ဆုံးထုထည်နှင့် ဖိအားသည် P 2 နှင့် V 2 ဖြစ်ရမည်။
ဤတွင် ကနဦး ထုထည်နှင့် ကနဦး ဖိအားသည် P 1 နှင့် V 1 ဖြစ်ပြီး၊ ထို့နောက် Boyle ၏ ဥပဒေ အရ-
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
ထို့ကြောင့် အဆက်မပြတ် အပူချိန်တွင် ဖိအားနှစ်ဆတိုးလာပါက ထိုဓာတ်ငွေ့၏ ထုထည်သည် ထက်ဝက်သို့ လျော့ကျသွားသည်။ လွတ်လပ်သောအခြေအနေတွင်၊ ဓာတ်ငွေ့သည် ပြန့်ကျဲနေသော မော်လီကျူးများကြောင့် ကွန်တိန်နာ၏ ထုထည်ပိုကြီးမှုကို သိမ်းပိုက်သည်။ ဓာတ်ငွေ့ဓာတ်ကို ဖိအားသက်ရောက်သောအခါ၊ ဤမော်လီကျူးများသည် ပိုမိုနီးကပ်လာပြီး ထုထည်ပိုနည်းလာသည်။ တစ်နည်းဆိုရသော် ဖိအားသည် ဓာတ်ငွေ့၏သိပ်သည်းဆနှင့် တိုက်ရိုက်အချိုးကျသည်။
ဤသည်မှာ Boyle's Law ၏ ဂရပ်ဖစ်ကိုယ်စားပြုမှုဖြစ်သည် ။
မြင့်မားသောအမြင့်တွင် လေထုဖိအားနည်းသောကြောင့် လေထုသိပ်သည်းမှုနည်းသည်။ ရလဒ်အနေနဲ့ အသက်ရှူဖို့အတွက် အောက်ဆီဂျင်နည်းပါတယ်။ ဤသည်မှာ တောင်တက်သမားများသည် အောက်ဆီဂျင်ဆလင်ဒါများကို သယ်ဆောင်ရသည့် အကြောင်းရင်းဖြစ်သည်။
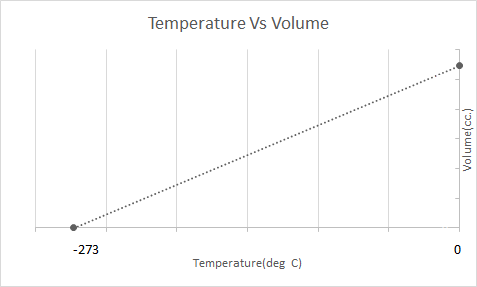
1787 ခုနှစ်တွင် Jacques Charles သည် အဆက်မပြတ်ဖိအားဖြင့် ဓာတ်ငွေ့တစ်ခု၏ ထုထည်အပေါ် အပူချိန်သက်ရောက်မှုကို လေ့လာခဲ့သည်။ Charles' Law က အဆက်မပြတ်ဖိအားနှင့် အဆက်မပြတ်ထုထည်တွင်၊ ဓာတ်ငွေ့ပမာဏသည် အပူချိန်နှင့် တိုက်ရိုက်အချိုးကျသည်ဟု ဖော်ပြထားသည်။
\(V ∝ T\)
\(V = yT\)
y သည် ဓာတ်ငွေ့ပမာဏနှင့် ဖိအားပေါ်မူတည်၍ ကိန်းသေတစ်ခုဖြစ်သည်။
Charles' Law ကို အောက်ပါအတိုင်း ဖော်ပြထားပါသည်။
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
ဆိုလိုသည်မှာ အပူချိန်တိုးလာသည်နှင့်အမျှ ထုထည်သည် တိုးလာလိမ့်မည်၊ အပူချိန်ကျဆင်းလာသည်နှင့်အမျှ အသံအတိုးအကျယ် ကျဆင်းလာသည်။ သူ၏ စမ်းသပ်မှုတွင် ဓာတ်ငွေ့တစ်ခု၏ ထုထည်ပမာဏသည် အပူချိန်တိုင်း ဒီဂရီတိုင်းတွင် မြင့်တက်ခြင်း သို့မဟုတ် ကျဆင်းခြင်းနှင့်အတူ မူလထုထည်၏ 1/273.15 ဆ တိုးလာခြင်း သို့မဟုတ် လျော့နည်းသွားကြောင်း တွက်ချက်ခဲ့သည်။
ထို့ကြောင့် Volume သည် V 0 ဖြစ်ပြီး 0 O C နှင့် V t သည် Volume t o C ဆိုလျှင်၊
\(V_t = V_0 + \frac{t}{273.15} V_0\)
ဤသည်မှာ Charles' Law ၏ ရုပ်ပုံလွှာကို ကိုယ်စားပြုသည်-
Charles' Law ၏အခြေခံပေါ်တွင် လေပူဖောင်းများ အလုပ်လုပ်သည်။ ပူဖောင်းအတွင်း ပိတ်မိနေသော လေကို မီးဖိုတစ်ခုက အပူပေးသောအခါ၊ လေမော်လီကျူးများသည် ပိုမိုမြန်ဆန်စွာ ရွေ့လျားလာပြီး ကျယ်ပြန့်လာသည်။ မီးပုံးပျံအတွင်းမှ ဓာတ်ငွေ့များသည် နေရာပိုယူကာ ၎င်းနှင့်ပတ်၀န်းကျင်ရှိ လေထက် သိပ်သည်းမှုနည်းလာသည်။ လေပူဖောင်းသည် သိပ်သည်းမှုနည်းလာသည်နှင့်အမျှ ၎င်းသည် တက်လာကာ လွင့်ပျံလာသည်။
ဒါကို Pressure Law လို့လည်း ခေါ်တယ်။ ၎င်းကို 1808 ခုနှစ်တွင် Joseph Louis Gay-Lussac မှ ရေးဆွဲခဲ့သည်။
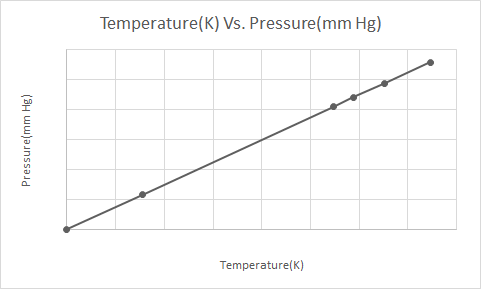
Gay Lussac ၏ ဥပဒေတွင် အဆက်မပြတ်ထုထည်တွင်၊ စံပြဓာတ်ငွေ့တစ်ခု၏ ဖိအားသည် ၎င်း၏ ပကတိအပူချိန် (Kelvin) နှင့် တိုက်ရိုက်အချိုးကျသည်ဟု ဖော်ပြထားသည်။
\(P ∝ T\)
\(P/T = k \)
ဘယ်မှာလဲ။
Gay-Lussac ၏ ဥပဒေ ကို အောက်ပါအတိုင်း ဖော်ပြနိုင်သည်။
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
ဘယ်မှာလဲ-
Gay-Lussac's Law အရ၊ ဓာတ်ငွေ့တစ်ခု၏ဖိအား (အဆက်မပြတ်ထုထည်တွင်ထားရှိ) သည် နောက်ဆုံးတွင် ငွေ့ရည်ဖွဲ့ပြီး အရည်ဖြစ်လာသည်အထိ အအေးခံထားသောကြောင့် အဆက်မပြတ်လျော့ကျသွားပါသည်။
ဤသည်မှာ Gay-Lussac's Law ၏ ဂရပ်ဖစ်ကိုယ်စားပြုမှုဖြစ်သည်။
ဖိအားပေးထားသော aerosol ဘူး (ဥပမာ- အနံ့ဆိုးဆေးဗူး သို့မဟုတ် မှုတ်ဆေးဘူး) ကို အပူပေးသောအခါ၊ ကွန်တိန်နာပေါ်ရှိ ဓာတ်ငွေ့များမှ ထွက်ပေါ်လာသော ဖိအားများ တိုးလာခြင်းကြောင့် ပေါက်ကွဲနိုင်သည်။ အဘယ်ကြောင့်ဆိုသော် ကွန်တိန်နာအများအပြားတွင် ကွန်တိန်နာကို မီးဘေးမှ ကင်းဝေးပြီး အေးမြသောပတ်ဝန်းကျင်တွင် သိမ်းဆည်းရမည်ဟု သတိပေးတံဆိပ်များပါရှိသည့် အကြောင်းရင်းဖြစ်သည်။
ဖိအားပေါင်းအိုးကို အပူပေးသောအခါ ကွန်တိန်နာအတွင်းရှိ ရေနွေးငွေ့မှ ထုတ်လွှတ်သော ဖိအားသည် တိုးလာသည်။ ကွန်တိန်နာအတွင်း မြင့်မားသော အပူချိန်နှင့် ဖိအားများသည် အစားအစာကို ချက်ပြုတ်ရာတွင် ပိုမိုမြန်ဆန်စေသည်။