त्यहाँ तीनवटा आधारभूत ग्यास नियमहरू छन् (बोयलको कानून, चार्ल्सको कानून, र एभोगाड्रोको कानून) जसले दबाब, तापक्रम, मात्रा र ग्यासको मात्राको सम्बन्धलाई वर्णन गर्दछ। यस पाठमा हामी निम्न कुराहरू छलफल गर्नेछौं
यसको नाम रोबर्ट बोयलको नाममा राखिएको हो।
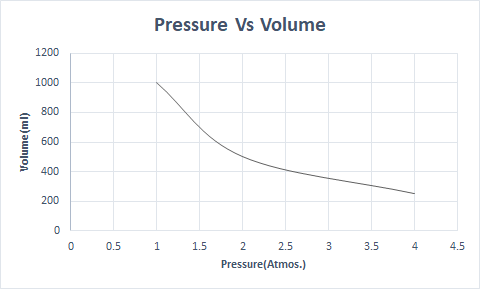
यसले तापमान र अणुहरूको संख्या स्थिर हुँदा भोल्युम दबावको विपरीत समानुपातिक हुन्छ भनी बताउँछ।
\(P ∝ 1/V\)
\(P = k_1V\)
कहाँ,
P दबाब हो
V भोल्युम हो
र, k 1 समानुपातिक स्थिरता हो
अब, यदि स्थिर तापक्रममा ग्यासको निश्चित पिण्ड विस्तार हुँदै जान्छ भने अन्तिम भोल्युम र दबाब P 2 र V 2 हुनेछ।
यहाँ प्रारम्भिक भोल्युम र प्रारम्भिक दबाब P 1 र V 1 हो, त्यसपछि Boyle को नियम अनुसार:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
यसरी, स्थिर तापक्रममा, यदि दबाब दोब्बर हुन्छ भने, त्यो ग्यासको मात्रा आधामा घटाइन्छ। मुक्त अवस्थामा, छरिएका अणुहरूको कारण ग्यासयुक्त पदार्थले कन्टेनरको ठूलो मात्रा ओगट्छ। जब ग्यासयुक्त पदार्थमा दबाब दिइन्छ, यी अणुहरू नजिक आउँछन् र कम मात्रा ओगट्छन्। अर्को शब्दमा, लागू गरिएको दबाब ग्यासको घनत्वसँग प्रत्यक्ष समानुपातिक हुन्छ।
यहाँ बोयलको कानूनको ग्राफिकल प्रतिनिधित्व छ:
उच्च उचाइमा, वायुमण्डलीय चाप कम हुन्छ त्यसैले हावा कम घना हुन्छ। फलस्वरूप, सास फेर्न कम अक्सिजन उपलब्ध छ। यही कारण पर्वतारोहीहरूले अक्सिजन सिलिन्डर बोक्ने गर्छन्।
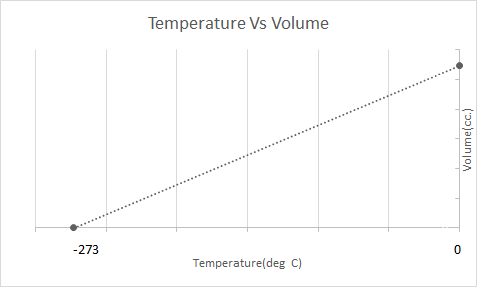
1787 मा, ज्याक चार्ल्सले स्थिर दबाबमा ग्यास पदार्थको मात्रामा तापक्रमको प्रभावको अध्ययन गरे। चार्ल्सको कानूनले बताउँछ कि स्थिर दबाब र स्थिर द्रव्यमानमा, ग्यासको आयतन तापक्रमसँग प्रत्यक्ष समानुपातिक हुन्छ।
\(V ∝ T\)
\(V = yT\)
जहाँ y ग्यास र दबाब को मात्रा मा निर्भर एक स्थिर छ।
चार्ल्सको कानून यसरी व्यक्त गरिएको छ:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
यसको मतलब तापमान वृद्धि संग मात्रा बढ्नेछ; घट्दो तापमान संग, भोल्युम घट्छ। आफ्नो प्रयोगमा, उनले गणना गरे कि ग्यासको दिइएको पिण्डको आयतन क्रमशः तापमानमा प्रत्येक डिग्री वृद्धि वा गिरावटको साथ मूल आयतनको 1/273.15 गुणाले बढ्छ वा घट्छ।
त्यसकारण, यदि भोल्युम V 0 0 O C मा छ र V t भनेको t o C मा भोल्युम हो भने,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
यहाँ चार्ल्स कानून को ग्राफिकल प्रतिनिधित्व छ:
तातो हावा बेलुनहरू चार्ल्सको कानूनको आधारमा काम गर्छन्। जब बर्नरले बेलुन भित्र फसेको हावालाई तताउँछ, हावाका अणुहरू छिटो सार्न थाल्छन् र विस्तार हुन्छन्। बेलुन भित्रको ग्यासले धेरै ठाउँ लिन्छ, यसको वरिपरिको हावा भन्दा कम घना हुन्छ। जब तातो हावाको बेलुन कम बाक्लो हुन्छ, यो माथि उठ्छ र तैरिन्छ।
यसलाई दबाब कानून पनि भनिन्छ। यो 1808 मा जोसेफ लुइस गे-लुसाक द्वारा तैयार गरिएको थियो।
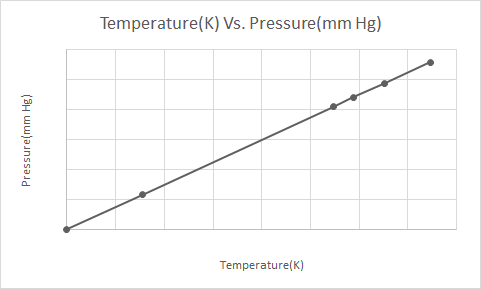
गे लुसाकको कानूनले बताउँछ कि स्थिर मात्रामा, एक आदर्श ग्याँसको दबाब यसको पूर्ण तापमान (केल्भिनमा) सँग प्रत्यक्ष समानुपातिक हुन्छ।
\(P ∝ T\)
\(P/T = k \)
कहाँ
गे-लुसाकको कानूनलाई यसरी व्यक्त गर्न सकिन्छ:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
कहाँ:
Gay-Lussac को कानून अनुसार, ग्यासको दबाब (स्थिर मात्रामा राखिएको) निरन्तर घट्दै जान्छ किनकि ग्यास अन्ततः संक्षेपणबाट गुज्रिएर तरल बन्न जाँदासम्म यो चिसो हुन्छ।
यहाँ गे-लुसाकको कानूनको ग्राफिकल प्रतिनिधित्व छ
जब प्रेसराइज्ड एरोसोल क्यान (जस्तै डिओडोरेन्ट क्यान वा स्प्रे-पेन्ट क्यान) तताइन्छ, कन्टेनरमा ग्यासहरू द्वारा निस्कने दबाबको परिणामस्वरूप विस्फोट हुन सक्छ। यही कारणले गर्दा धेरै प्रेसराइज्ड कन्टेनरहरूमा चेतावनी लेबलहरू छन् कि कन्टेनरलाई आगोबाट टाढा राख्नुपर्छ र चिसो वातावरणमा भण्डारण गर्नुपर्छ।
जब प्रेसर कुकर तताइन्छ, कन्टेनर भित्रको भापले दबाब बढ्छ। कन्टेनर भित्रको उच्च तापक्रम र दबाबले खाना छिटो पकाउन मद्दत गर्छ।