Istnieją trzy podstawowe prawa gazowe (prawo Boyle'a, prawo Charlesa i prawo Avogadro), które opisują zależność między ciśnieniem, temperaturą, objętością i ilością gazu. W tej lekcji omówimy następujące kwestie
Jej nazwa pochodzi od Roberta Boyle'a.
Oznacza to, że objętość jest odwrotnie proporcjonalna do ciśnienia, gdy temperatura i liczba cząsteczek są stałe.
\(P ∝ 1/V\)
\(P = k_1V\)
Gdzie,
P to ciśnienie
V to objętość
a k1 jest stałą proporcjonalności
Teraz, jeśli ustalona masa gazu ulega rozprężeniu w stałej temperaturze, to końcowa objętość i ciśnienie będą wynosić P 2 i V 2 .
Początkowa objętość i początkowe ciśnienie wynoszą tutaj P 1 i V 1 , a następnie zgodnie z prawem Boyle'a:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Tak więc, w stałej temperaturze, jeśli ciśnienie zostanie podwojone, objętość tego gazu zmniejszy się o połowę. W stanie wolnym substancja gazowa zajmuje większą objętość pojemnika ze względu na rozproszone cząsteczki. Kiedy ciśnienie jest przykładane do substancji gazowej, cząsteczki te zbliżają się i zajmują mniejszą objętość. Innymi słowy, zastosowane ciśnienie jest wprost proporcjonalne do gęstości gazu.
Oto graficzna reprezentacja prawa Boyle'a:
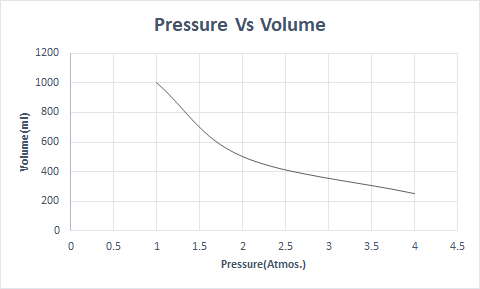
Na wyższych wysokościach ciśnienie atmosferyczne jest niskie, więc powietrze jest mniej gęste. W rezultacie mniej tlenu jest dostępne do oddychania. To jest powód, dla którego alpiniści noszą butle z tlenem.
W 1787 roku Jacques Charles badał wpływ temperatury na objętość substancji gazowej przy stałym ciśnieniu. Prawo Charlesa mówi, że przy stałym ciśnieniu i stałej masie objętość gazu jest wprost proporcjonalna do temperatury.
\(V ∝ T\)
\(V = yT\)
Gdzie y jest stałą zależną od ilości gazu i ciśnienia.
Prawo Karola wyraża się jako:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Oznacza to, że wraz ze wzrostem temperatury objętość będzie rosła; wraz ze spadkiem temperatury objętość maleje. W swoim eksperymencie obliczył, że objętość gazu o określonej masie zwiększa się lub zmniejsza o 1/273,15 objętości pierwotnej wraz ze wzrostem lub spadkiem temperatury o każdy stopień.
Dlatego, jeśli objętość wynosi V 0 w temperaturze 0 o C, a V t jest objętością w temperaturze t o C, to
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Oto graficzna reprezentacja prawa Karola:
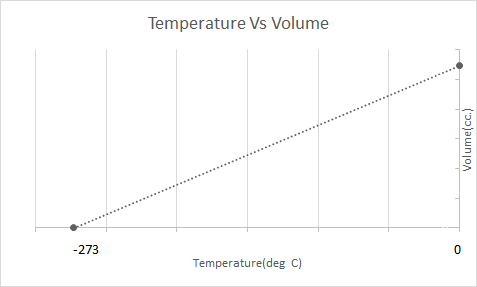
Balony na ogrzane powietrze działają w oparciu o prawo Karola. Kiedy palnik ogrzewa powietrze uwięzione w balonie, cząsteczki powietrza zaczynają poruszać się szybciej i rozszerzają się. Gaz wewnątrz balonu zajmuje więcej miejsca, stając się mniej gęsty niż otaczające go powietrze. Gdy balon na ogrzane powietrze staje się mniej gęsty, unosi się i unosi.
Jest to również znane jako prawo ciśnienia. Został sformułowany przez Josepha Louisa Gay-Lussaca w 1808 roku.
Prawo Gay Lussac mówi, że przy stałej objętości ciśnienie gazu doskonałego jest wprost proporcjonalne do jego temperatury bezwzględnej (w kelwinach).
\(P ∝ T\)
\(P/T = k \)
Gdzie
Prawo Gay-Lussaca można wyrazić jako:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Gdzie:
Zgodnie z prawem Gay-Lussaca ciśnienie gazu (utrzymywanego na stałym poziomie objętości) zmniejsza się stale w miarę jego ochładzania, aż w końcu gaz ulegnie kondensacji i stanie się cieczą.
Oto graficzna reprezentacja prawa Gay-Lussaca
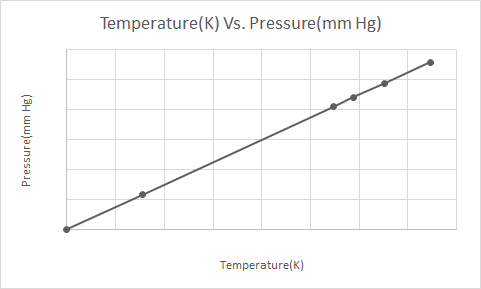
Gdy pojemnik z aerozolem pod ciśnieniem (np. pojemnik z dezodorantem lub pojemnik z farbą w sprayu) zostanie podgrzany, wynikający z tego wzrost ciśnienia wywieranego przez gazy na pojemnik może spowodować wybuch. To jest powód, dla którego wiele pojemników ciśnieniowych ma etykiety ostrzegawcze informujące, że pojemnik należy trzymać z dala od ognia i przechowywać w chłodnym otoczeniu.
Gdy szybkowar jest podgrzewany, ciśnienie wywierane przez parę wewnątrz pojemnika wzrasta. Wysoka temperatura i ciśnienie wewnątrz pojemnika powodują, że żywność gotuje się szybciej.