Existem três leis fundamentais dos gases (Lei de Boyle, Lei de Charles e Lei de Avogadro) que descrevem a relação entre pressão, temperatura, volume e quantidade de gás. Nesta lição, vamos discutir o seguinte
É nomeado após Robert Boyle.
Isso afirma que o volume é inversamente proporcional à pressão quando a temperatura e o número de moléculas são constantes.
\(P ∝ 1/V\)
\(P = k_1V\)
Onde,
P é a pressão
V é o volume
e, k 1 é a constante de proporcionalidade
Agora, se uma massa fixa de gás sofre uma expansão a temperatura constante, então o volume e a pressão finais serão P 2 e V 2 .
O volume inicial e a pressão inicial aqui são P 1 e V 1 , então de acordo com a lei de Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Assim, a uma temperatura constante, se a pressão for dobrada, o volume desse gás é reduzido à metade. No estado livre, uma substância gasosa ocupa um volume maior do recipiente devido às moléculas espalhadas. Quando a pressão é aplicada à substância gasosa, essas moléculas se aproximam e ocupam um volume menor. Em outras palavras, a pressão aplicada é diretamente proporcional à densidade do gás.
Aqui está a representação gráfica da Lei de Boyle:
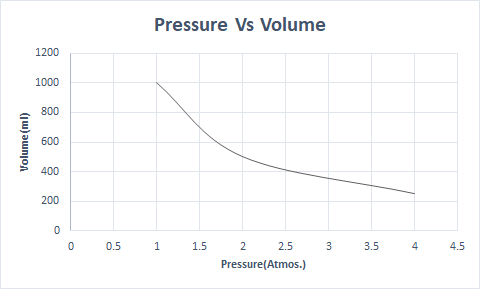
Em altitudes mais elevadas, a pressão atmosférica é baixa, então o ar é menos denso. Como resultado, menos oxigênio está disponível para a respiração. Esta é a razão pela qual os montanhistas carregam cilindros de oxigênio.
Em 1787, Jacques Charles estudou o efeito da temperatura no volume de uma substância gasosa a pressão constante. A Lei de Charles afirma que a pressão constante e massa constante, o volume de um gás é diretamente proporcional à temperatura.
\(V ∝ T\)
\(V = yT\)
Onde y é uma constante dependendo da quantidade de gás e pressão.
A Lei de Charles é expressa como:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Isso significa que com o aumento da temperatura o volume aumentará; com a diminuição da temperatura, o volume diminui. Em seu experimento, ele calculou que o volume de uma dada massa de um gás aumenta ou diminui em 1/273,15 vezes do volume original com cada grau de aumento ou queda na temperatura, respectivamente.
Portanto, se o volume é V 0 em 0 O C e V t é o volume em t o C então,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Aqui está a representação gráfica da Lei de Charles:
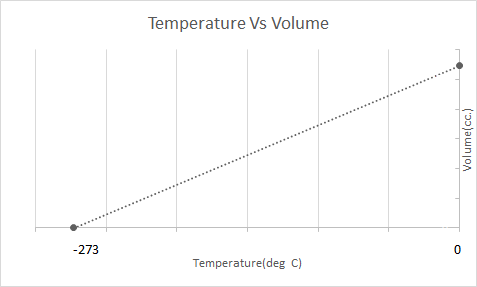
Balões de ar quente funcionam com base na Lei de Charles. Quando um queimador aquece o ar preso dentro do balão, as moléculas de ar começam a se mover mais rápido e se expandem. O gás dentro do balão ocupa mais espaço, tornando-se menos denso que o ar ao seu redor. À medida que o balão de ar quente se torna menos denso, ele sobe e flutua.
Isso também é conhecido como a Lei da Pressão. Foi formulado por Joseph Louis Gay-Lussac em 1808.
A Lei de Gay Lussac afirma que a volume constante, a pressão de um gás ideal é diretamente proporcional à sua temperatura absoluta (em Kelvin).
\(P ∝ T\)
\(P/T = k \)
Onde
A Lei de Gay-Lussac pode ser expressa como:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Onde:
De acordo com a Lei de Gay-Lussac, a pressão de um gás (mantida em volume constante) diminui constantemente à medida que é resfriado até que o gás eventualmente sofra condensação e se torne um líquido.
Aqui está a representação gráfica da Lei de Gay-Lussac
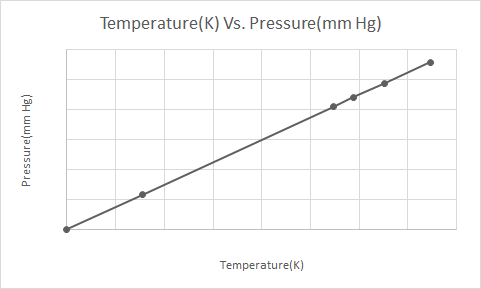
Quando uma lata de aerossol pressurizada (por exemplo, lata de desodorante ou lata de tinta spray) é aquecida, o aumento resultante na pressão exercida pelos gases no recipiente pode resultar em uma explosão. Esta é a razão pela qual muitos recipientes pressurizados têm etiquetas de advertência informando que o recipiente deve ser mantido longe do fogo e armazenado em um ambiente fresco.
Quando uma panela de pressão é aquecida, a pressão exercida pelo vapor dentro do recipiente aumenta. A alta temperatura e pressão dentro do recipiente fazem com que os alimentos cozinhem mais rápido.