Существуют три основных газовых закона (закон Бойля, закон Шарля и закон Авогадро), которые описывают взаимосвязь между давлением, температурой, объемом и количеством газа. На этом уроке мы обсудим следующие
Он назван в честь Роберта Бойля.
Это утверждает, что объем обратно пропорционален давлению, когда температура и число молекул постоянны.
\(P ∝ 1/V\)
\(P = k_1V\)
куда,
P - давление
V - это объем
k 1 – константа пропорциональности
Теперь, если фиксированная масса газа подвергается расширению при постоянной температуре, то конечный объем и давление должны быть P 2 и V 2 .
Начальный объем и начальное давление здесь равны P 1 и V 1 , тогда по закону Бойля:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Таким образом, при постоянной температуре, если давление удвоится, объем этого газа уменьшится вдвое. В свободном состоянии газообразное вещество занимает больший объем сосуда за счет рассеянных молекул. Когда к газообразному веществу прикладывается давление, эти молекулы сближаются и занимают меньший объем. Другими словами, прикладываемое давление прямо пропорционально плотности газа.
Вот графическое представление закона Бойля:
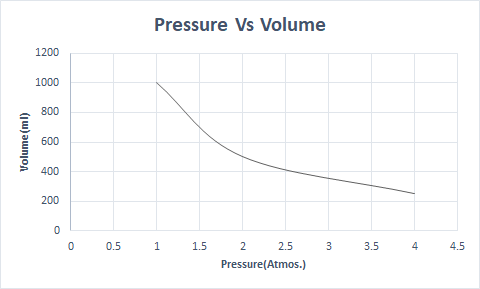
На большей высоте атмосферное давление низкое, поэтому воздух менее плотный. В результате меньше кислорода доступно для дыхания. По этой причине альпинисты носят с собой кислородные баллоны.
В 1787 году Жак Шарль изучил влияние температуры на объем газообразного вещества при постоянном давлении. Закон Чарльза гласит, что при постоянном давлении и постоянной массе объем газа прямо пропорционален температуре.
\(V ∝ T\)
\(V = yT\)
Где y - константа, зависящая от количества газа и давления.
Закон Чарльза выражается как:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Это означает, что с повышением температуры объем должен увеличиваться; с понижением температуры объем уменьшается. В своем эксперименте он подсчитал, что объем данной массы газа увеличивается или уменьшается в 1/273,15 раза от первоначального объема с каждым градусом повышения или понижения температуры соответственно.
Следовательно, если объем равен V 0 при 0 °C, а V t — объем при t ° C, то
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Вот графическое представление закона Чарльза:
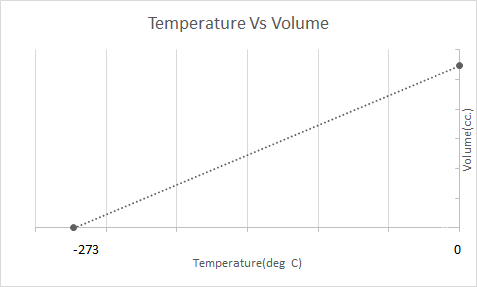
Воздушные шары работают по закону Чарльза. Когда горелка нагревает воздух, находящийся внутри воздушного шара, молекулы воздуха начинают двигаться быстрее и расширяются. Газ внутри шара занимает больше места, становясь менее плотным, чем окружающий его воздух. Когда воздушный шар становится менее плотным, он поднимается вверх и парит.
Это также известно как закон давления. Он был сформулирован Жозефом Луи Гей-Люссаком в 1808 году.
Закон Гей-Люссака гласит, что при постоянном объеме давление идеального газа прямо пропорционально его абсолютной температуре (в градусах Кельвина).
\(P ∝ T\)
\(P/T = k \)
куда
Закон Гей-Люссака может быть выражен как:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Где:
Согласно закону Гей-Люссака, давление газа (удерживаемого при постоянном объеме) постоянно уменьшается по мере его охлаждения до тех пор, пока газ в конце концов не конденсируется и не становится жидкостью.
Вот графическое представление закона Гей-Люссака.
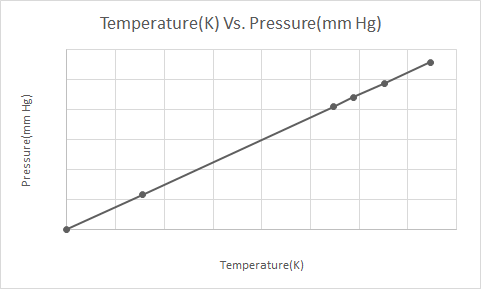
Когда аэрозольный баллончик под давлением (например, баллончик с дезодорантом или аэрозольный баллончик с краской) нагревается, возникающее в результате увеличение давления, оказываемого газами на контейнер, может привести к взрыву. По этой причине многие контейнеры под давлением имеют предупреждающие этикетки о том, что контейнер следует хранить вдали от огня и в прохладном месте.
Когда скороварка нагревается, давление пара внутри контейнера увеличивается. Высокая температура и давление внутри контейнера заставляют пищу готовиться быстрее.