Ekzistojnë tre ligje themelore të gazit (Ligji i Boyle-it, Ligji i Charles-it dhe Ligji i Avogadro-s) që përshkruan marrëdhënien e presionit, temperaturës, vëllimit dhe sasisë së gazit. Në këtë mësim, ne do të diskutojmë sa vijon
Është emëruar pas Robert Boyle.
Kjo thotë se vëllimi është në përpjesëtim të zhdrejtë me presionin kur temperatura dhe numri i molekulave janë konstante.
\(P ∝ 1/V\)
\(P = k_1V\)
ku,
P është presioni
V është vëllimi
dhe, k 1 është konstanta e proporcionalitetit
Tani, nëse një masë fikse gazi i nënshtrohet një zgjerimi në temperaturë konstante, atëherë vëllimi dhe presioni përfundimtar do të jenë P 2 dhe V 2 .
Vëllimi fillestar dhe presioni fillestar këtu është P 1 dhe V 1 , atëherë sipas ligjit të Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Kështu, në një temperaturë konstante, nëse presioni dyfishohet, vëllimi i atij gazi zvogëlohet në gjysmë. Në një gjendje të lirë, një substancë e gaztë zë një vëllim më të madh të enës për shkak të molekulave të shpërndara. Kur presioni ushtrohet në substancën e gaztë, këto molekula afrohen më shumë dhe zënë një vëllim më të vogël. Me fjalë të tjera, presioni i aplikuar është drejtpërdrejt proporcional me densitetin e gazit.
Këtu është paraqitja grafike e Ligjit të Boyle:
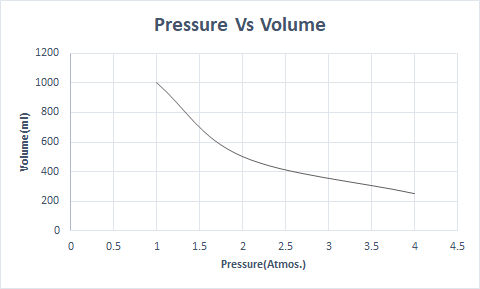
Në lartësi më të madhe, presioni atmosferik është i ulët, kështu që ajri është më pak i dendur. Si rezultat, disponohet më pak oksigjen për frymëmarrje. Kjo është arsyeja pse alpinistët mbajnë bombola oksigjeni.
Në 1787, Jacques Charles studioi efektin e temperaturës në vëllimin e një lënde të gaztë në një presion konstant. Ligji i Charles thotë se në presion konstant dhe masë konstante, vëllimi i një gazi është drejtpërdrejt proporcional me temperaturën.
\(V ∝ T\)
\(V = yT\)
Ku y është një konstante në varësi të sasisë së gazit dhe presionit.
Ligji i Charles shprehet si:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Kjo do të thotë se me rritjen e temperaturës vëllimi do të rritet; me uljen e temperaturës, vëllimi zvogëlohet. Në eksperimentin e tij, ai llogariti se vëllimi i një mase të caktuar të një gazi rritet ose zvogëlohet me 1/273.15 herë të vëllimit fillestar me çdo shkallë rritje ose rënie të temperaturës përkatësisht.
Prandaj, nëse vëllimi është V 0 në 0 O C dhe V t është vëllimi në t o C atëherë,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Këtu është paraqitja grafike e Ligjit të Charles:
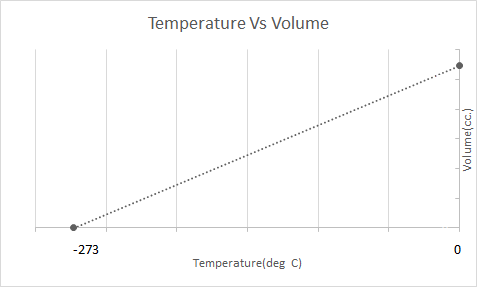
Balonat e ajrit të nxehtë punojnë në bazë të ligjit të Charles. Kur një djegës ngroh ajrin e bllokuar brenda balonës, molekulat e ajrit fillojnë të lëvizin më shpejt dhe zgjerohen. Gazi brenda balonës zë më shumë hapësirë, duke u bërë më pak i dendur se ajri që e rrethon. Ndërsa baloni i ajrit të nxehtë bëhet më pak i dendur, ai ngrihet lart dhe noton.
Ky njihet edhe si Ligji i Presionit. Ajo u formulua nga Joseph Louis Gay-Lussac në 1808.
Ligji i Gay Lussac thotë se në vëllim konstant, presioni i një gazi ideal është drejtpërdrejt proporcional me temperaturën e tij absolute (në Kelvin).
\(P ∝ T\)
\(P/T = k \)
ku
Ligji i Gay-Lussac mund të shprehet si:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Ku:
Sipas ligjit të Gay-Lussac, presioni i një gazi (i mbajtur në vëllim konstant) zvogëlohet vazhdimisht ndërsa ftohet derisa gazi përfundimisht t'i nënshtrohet kondensimit dhe të bëhet i lëngshëm.
Këtu është paraqitja grafike e Ligjit të Gay-Lussac
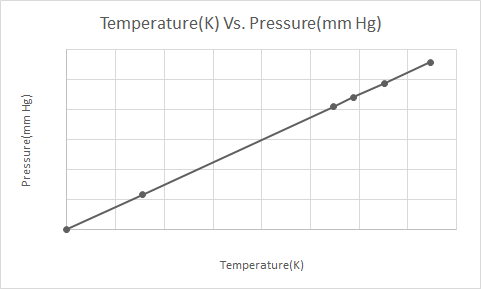
Kur një kanaçe aerosoli nën presion (p.sh. kuti me deodorant ose bojë me llak) nxehet, rritja që rezulton në presionin e ushtruar nga gazrat në enë mund të rezultojë në një shpërthim. Kjo është arsyeja pse shumë kontejnerë nën presion kanë etiketa paralajmëruese që thonë se kontejneri duhet të mbahet larg zjarrit dhe të ruhet në një mjedis të freskët.
Kur një tenxhere me presion nxehet, presioni i ushtruar nga avulli brenda enës rritet. Temperatura dhe presioni i lartë brenda enës bëjnë që ushqimi të gatuhet më shpejt.