Det finns tre grundläggande gaslagar (Boyles lag, Charles lag och Avogadros lag) som beskriver förhållandet mellan tryck, temperatur, volym och mängd gas. I den här lektionen kommer vi att diskutera följande
Den är uppkallad efter Robert Boyle.
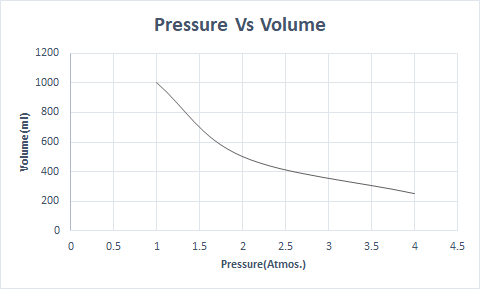
Detta anger att volymen är omvänt proportionell mot trycket när temperaturen och antalet molekyler är konstanta.
\(P ∝ 1/V\)
\(P = k_1V\)
var,
P är trycket
V är volymen
och k 1 är proportionalitetskonstanten
Om nu en fast massa av gas genomgår en expansion vid konstant temperatur ska slutvolymen och trycket vara P 2 och V 2 .
Den initiala volymen och initialtrycket här är P 1 och V 1 , då enligt Boyles lag:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Således, vid en konstant temperatur, om trycket fördubblas, reduceras volymen av den gasen till hälften. I ett fritt tillstånd upptar ett gasformigt ämne en större volym av behållaren på grund av de spridda molekylerna. När tryck appliceras på det gasformiga ämnet kommer dessa molekyler närmare och upptar en mindre volym. Med andra ord är trycket som appliceras direkt proportionellt mot gasens densitet.
Här är den grafiska representationen av Boyles lag:
På högre höjd är atmosfärstrycket lågt så luften är mindre tät. Som ett resultat är mindre syre tillgängligt för andning. Detta är anledningen till att bergsbestigare bär syrgasflaskor.
1787 studerade Jacques Charles effekten av temperatur på volymen av ett gasformigt ämne vid konstant tryck. Charles lag säger att vid konstant tryck och konstant massa är volymen av en gas direkt proportionell mot temperaturen.
\(V ∝ T\)
\(V = yT\)
Där y är en konstant beroende på mängden gas och tryck.
Charles' Law uttrycks som:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
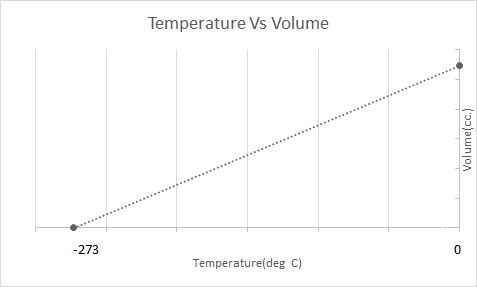
Detta betyder att med temperaturökningen ska volymen öka; med sjunkande temperatur minskar volymen. I sitt experiment beräknade han att volymen av en given massa av en gas ökar eller minskar med 1/273,15 gånger den ursprungliga volymen med varje grads ökning eller minskning av temperaturen.
Därför, om volymen är V 0 vid 0 O C och V t är volymen vid t o C då,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Här är den grafiska representationen av Charles' Law:
Luftballonger fungerar utifrån Charles' lag. När en brännare värmer luften som är instängd inuti ballongen börjar luftmolekylerna röra sig snabbare och expanderar. Gasen inuti ballongen tar upp mer plats och blir mindre tät än luften som omger den. När luftballongen blir mindre tät stiger den upp och flyter.
Detta är också känt som trycklagen. Den formulerades av Joseph Louis Gay-Lussac 1808.
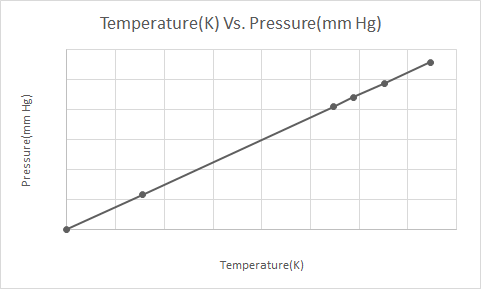
Gay Lussacs lag säger att vid konstant volym är trycket hos en idealgas direkt proportionell mot dess absoluta temperatur (i Kelvin).
\(P ∝ T\)
\(P/T = k \)
var
Gay-Lussacs lag kan uttryckas som:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Var:
Enligt Gay-Lussacs lag minskar trycket hos en gas (hålls vid konstant volym) konstant när den kyls tills gasen så småningom genomgår kondensation och blir en vätska.
Här är den grafiska representationen av Gay-Lussacs lag
När en trycksatt aerosolburk (t.ex. deodorantburk eller sprayburk) värms upp kan den resulterande ökningen av trycket som utövas av gaserna på behållaren resultera i en explosion. Detta är anledningen till att många trycksatta behållare har varningsetiketter som säger att behållaren måste hållas borta från eld och förvaras i en sval miljö.
När en tryckkokare värms upp ökar trycket som utövas av ångan inuti behållaren. Den höga temperaturen och trycket inuti behållaren gör att maten tillagas snabbare.