มีกฎพื้นฐานของแก๊สสามข้อ (กฎของบอยล์ กฎของชาร์ลส์ และกฎของอาโวกาโดร) ที่อธิบายความสัมพันธ์ของความดัน อุณหภูมิ ปริมาตร และปริมาณของแก๊ส ในบทเรียนนี้ เราจะพูดถึงสิ่งต่อไปนี้
มันถูกตั้งชื่อตามโรเบิร์ต บอยล์
สิ่งนี้ระบุว่าปริมาตรแปรผกผันกับความดันเมื่ออุณหภูมิและจำนวนโมเลกุลคงที่
\(P ∝ 1/V\)
\(P = k_1V\)
ที่ไหน,
P คือความดัน
V คือปริมาตร
และ k 1 คือค่าคงที่สัดส่วน
ทีนี้ ถ้าแก๊สมวลคงที่เกิดการขยายตัวที่อุณหภูมิคงที่ ปริมาตรและความดันสุดท้ายจะเป็น P 2 และ V 2
ปริมาตรเริ่มต้นและความดันเริ่มต้นที่นี่คือ P 1 และ V 1 จากนั้นเป็นไปตามกฎของ Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
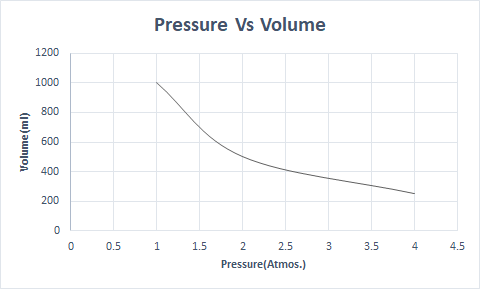
ดังนั้น ที่อุณหภูมิคงที่ ถ้าความดันเพิ่มขึ้นเป็นสองเท่า ปริมาตรของก๊าซนั้นจะลดลงเหลือครึ่งหนึ่ง ในสถานะอิสระ สารที่เป็นก๊าซจะครอบครองภาชนะบรรจุในปริมาณที่มากขึ้นเนื่องจากโมเลกุลที่กระจัดกระจาย เมื่อใช้ความดันกับสารที่เป็นก๊าซ โมเลกุลเหล่านี้จะเข้าใกล้และมีปริมาตรน้อยลง กล่าวอีกนัยหนึ่ง ความดันที่ใช้เป็นสัดส่วนโดยตรงกับความหนาแน่นของก๊าซ
นี่คือการแสดงกราฟิกของกฎของ Boyle:
ที่ระดับความสูงที่สูงขึ้น ความกดอากาศจะต่ำ อากาศจึงมีความหนาแน่นน้อยลง เป็นผลให้มีออกซิเจนน้อยลงสำหรับการหายใจ นี่คือเหตุผลที่นักปีนเขาพกถังออกซิเจน
ในปี 1787 Jacques Charles ได้ศึกษาผลกระทบของอุณหภูมิต่อปริมาตรของสารก๊าซที่ความดันคงที่ กฎของชาร์ลส์กล่าวว่าที่ความดันคงที่และมวลคงที่ ปริมาตรของก๊าซจะแปรผันโดยตรงกับอุณหภูมิ
\(V ∝ T\)
\(V = yT\)
โดยที่ y เป็นค่าคงที่ขึ้นอยู่กับปริมาณของแก๊สและความดัน
กฎของชาร์ลส์แสดงเป็น:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
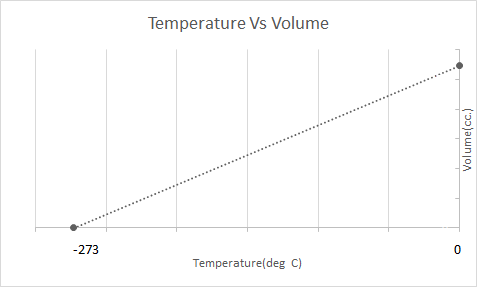
ซึ่งหมายความว่าเมื่ออุณหภูมิเพิ่มขึ้นปริมาตรจะเพิ่มขึ้น เมื่ออุณหภูมิลดลงปริมาตรจะลดลง ในการทดลอง เขาคำนวณว่าปริมาตรของมวลของก๊าซหนึ่งๆ จะเพิ่มขึ้นหรือลดลง 1/273.15 เท่าของปริมาตรเดิม โดยที่ทุกองศาจะเพิ่มขึ้นหรือลดลงตามอุณหภูมิตามลำดับ
ดังนั้น ถ้าปริมาตรเป็น V 0 ที่ 0 O C และ V t เป็นปริมาตรที่ t o C ดังนั้น
\(V_t = V_0 + \frac{t}{273.15} V_0\)
นี่คือการแสดงกราฟิกของกฎของชาร์ลส์:
บอลลูนอากาศร้อนทำงานตามกฎของชาร์ลส์ เมื่อหัวเผาให้ความร้อนแก่อากาศที่ติดอยู่ภายในบอลลูน โมเลกุลของอากาศจะเริ่มเคลื่อนที่เร็วขึ้นและขยายตัวขึ้น ก๊าซภายในบอลลูนใช้พื้นที่มากขึ้น และมีความหนาแน่นน้อยกว่าอากาศที่อยู่รอบๆ เมื่อบอลลูนมีความหนาแน่นน้อยลง มันก็ลอยขึ้นและลอยขึ้น
สิ่งนี้เรียกอีกอย่างว่ากฎความดัน คิดค้นโดย Joseph Louis Gay-Lussac ในปี 1808
กฎของเกย์ ลูสแซก (Gay Lussac's Law) กล่าวว่า ที่ปริมาตรคงที่ ความดันของก๊าซในอุดมคติจะแปรผันโดยตรงกับอุณหภูมิสัมบูรณ์ (หน่วยเป็นเคลวิน)
\(P ∝ T\)
\(P/T = k \)
ที่ไหน
กฎของเกย์-ลูสแซกสามารถแสดงเป็น:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
ที่ไหน:
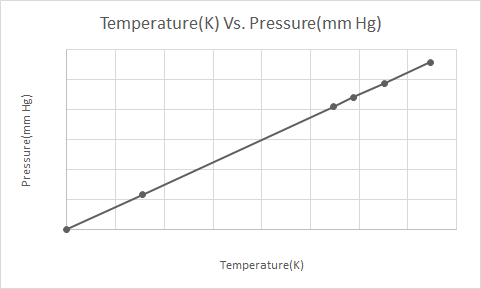
ตามกฎของเกย์-ลูสแซก ความดันของแก๊ส (คงอยู่ที่ปริมาตรคงที่) จะลดลงอย่างต่อเนื่องเมื่อถูกทำให้เย็นลง จนกระทั่งแก๊สเกิดการควบแน่นและกลายเป็นของเหลวในที่สุด
นี่คือการแสดงกราฟิกของกฎของเกย์-ลูสแซก
เมื่อกระป๋องสเปรย์อัดความดัน (เช่น กระป๋องระงับกลิ่นกายหรือกระป๋องสีสเปรย์) ถูกทำให้ร้อน แรงดันที่เพิ่มขึ้นที่กระทำโดยก๊าซบนภาชนะอาจส่งผลให้เกิดการระเบิดได้ นี่คือเหตุผลว่าทำไมภาชนะบรรจุแรงดันจำนวนมากจึงมีฉลากเตือนว่าจะต้องเก็บภาชนะให้ห่างจากไฟและเก็บไว้ในสภาพแวดล้อมที่เย็น
เมื่อหม้ออัดแรงดันถูกทำให้ร้อน แรงดันที่เกิดจากไอน้ำภายในภาชนะจะเพิ่มขึ้น อุณหภูมิและความดันสูงภายในภาชนะทำให้อาหารสุกเร็วขึ้น