May tatlong pangunahing batas ng gas (Boyle's Law, Charles' Law, at Avogadro's Law) na naglalarawan sa relasyon ng pressure, temperatura, volume at dami ng gas. Sa araling ito, tatalakayin natin ang mga sumusunod
Ipinangalan ito kay Robert Boyle.
Ito ay nagsasaad na ang volume ay inversely proportional sa pressure kapag ang temperatura at ang bilang ng mga molecule ay pare-pareho.
\(P ∝ 1/V\)
\(P = k_1V\)
saan,
P ay ang presyon
Ang V ay ang Volume
at, ang k 1 ay ang proporsyonalidad na pare-pareho
Ngayon, kung ang isang nakapirming masa ng gas ay sumasailalim sa isang pagpapalawak sa pare-parehong temperatura kung gayon ang huling dami at presyon ay magiging P 2 at V 2 .
Ang paunang dami at paunang presyon dito ay P 1 at V 1 , pagkatapos ay ayon sa batas ni Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Kaya, sa isang pare-pareho ang temperatura, kung ang presyon ay nadoble, ang dami ng gas na iyon ay nabawasan sa kalahati. Sa isang libreng estado, ang isang gas na sangkap ay sumasakop sa isang mas malaking dami ng lalagyan dahil sa mga nakakalat na molekula. Kapag ang presyon ay inilapat sa gaseous substance, ang mga molekula na ito ay lalapit at sumasakop sa mas kaunting volume. Sa madaling salita, ang presyon na inilapat ay direktang proporsyonal sa density ng gas.
Narito ang graphical na representasyon ng Batas ni Boyle:
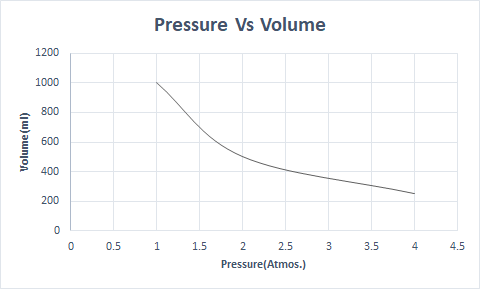
Sa mas mataas na altitude, mababa ang atmospheric pressure kaya hindi gaanong siksik ang hangin. Bilang resulta, mas kaunting oxygen ang magagamit para sa paghinga. Ito ang dahilan kung bakit ang mga mountaineer ay nagdadala ng mga cylinder ng oxygen.
Noong 1787, pinag-aralan ni Jacques Charles ang epekto ng temperatura sa dami ng isang gaseous substance sa pare-parehong presyon. Ang Batas ni Charles ay nagsasaad na sa pare-pareho ang presyon at pare-pareho ang masa, ang dami ng isang gas ay direktang proporsyonal sa temperatura.
\(V ∝ T\)
\(V = yT\)
Kung saan ang y ay isang pare-pareho depende sa dami ng gas at presyon.
Ang Batas ni Charles ay ipinahayag bilang:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Nangangahulugan ito na sa pagtaas ng temperatura ang volume ay tataas; sa pagbaba ng temperatura, bumababa ang volume. Sa kanyang eksperimento, kinakalkula niya na ang volume ng isang binigay na masa ng isang gas ay tumataas o bumaba ng 1/273.15 beses ng orihinal na volume sa bawat antas ng pagtaas o pagbaba sa temperatura ayon sa pagkakabanggit.
Samakatuwid, kung ang volume ay V 0 sa 0 O C at V t ay ang volume sa t o C kung gayon,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Narito ang graphical na representasyon ng Charles' Law:
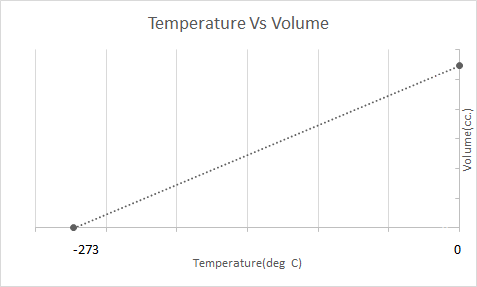
Gumagana ang mga hot air balloon batay sa Batas ni Charles. Kapag pinainit ng isang burner ang hangin na nakulong sa loob ng lobo, ang mga molekula ng hangin ay nagsisimulang gumalaw nang mas mabilis at lumalawak. Ang gas sa loob ng lobo ay tumatagal ng mas maraming espasyo, na nagiging mas siksik kaysa sa hangin na nakapalibot dito. Habang ang hot air balloon ay nagiging hindi gaanong siksik, ito ay tumataas at lumulutang.
Ito ay kilala rin bilang ang Pressure Law. Ito ay binuo ni Joseph Louis Gay-Lussac noong 1808.
Ang Batas ng Gay Lussac ay nagsasaad na sa pare-parehong dami, ang presyon ng isang perpektong gas ay direktang proporsyonal sa ganap na temperatura nito (sa Kelvin).
\(P ∝ T\)
\(P/T = k \)
saan
Ang Batas ng Gay-Lussac ay maaaring ipahayag bilang:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
saan:
Ayon sa Batas ng Gay-Lussac, ang presyon ng isang gas (pinananatili sa pare-parehong volume) ay patuloy na bumababa habang ito ay pinalamig hanggang sa ang gas ay tuluyang sumasailalim sa condensation at nagiging likido.
Narito ang graphical na representasyon ng Batas ng Gay-Lussac
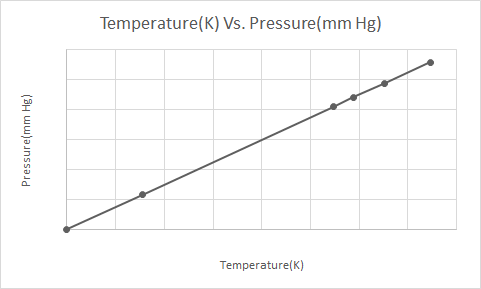
Kapag ang isang de-pressure na lata ng aerosol (hal. deodorant can o spray-paint can) ay pinainit, ang resultang pagtaas ng pressure na ibinibigay ng mga gas sa lalagyan ay maaaring magresulta sa pagsabog. Ito ang dahilan kung bakit maraming may pressure na lalagyan ang may mga label ng babala na nagsasaad na ang lalagyan ay dapat na ilayo sa apoy at itago sa isang malamig na kapaligiran.
Kapag pinainit ang pressure cooker, tataas ang pressure na dulot ng singaw sa loob ng lalagyan. Ang mataas na temperatura at presyon sa loob ng lalagyan ay nagiging sanhi ng mas mabilis na pagluluto ng pagkain.