Gazın basınç, sıcaklık, hacim ve miktar ilişkisini açıklayan üç temel gaz kanunu (Boyle Kanunu, Charles Kanunu ve Avogadro Kanunu) vardır. Bu derste, aşağıdakileri tartışacağız
Adını Robert Boyle'dan almıştır.
Bu, sıcaklık ve molekül sayısı sabit olduğunda hacmin basınçla ters orantılı olduğunu belirtir.
\(P ∝ 1/V\)
\(P = k_1V\)
nerede,
P basınçtır
V, Hacimdir
ve, k 1 orantılılık sabitidir
Şimdi, eğer sabit bir gaz kütlesi sabit sıcaklıkta genleşirse, son hacim ve basınç P 2 ve V 2 olacaktır.
Buradaki ilk hacim ve ilk basınç P 1 ve V 1 , o zaman Boyle yasasına göre:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Böylece sabit sıcaklıkta basınç iki katına çıkarsa o gazın hacmi yarı yarıya azalır. Serbest durumda, gaz halindeki bir madde, dağılmış moleküller nedeniyle kabın daha büyük bir hacmini kaplar. Gaz halindeki maddeye basınç uygulandığında bu moleküller birbirine yaklaşır ve daha az hacim kaplar. Yani uygulanan basınç gazın yoğunluğu ile doğru orantılıdır.
Boyle Yasasının grafiksel gösterimi şu şekildedir:
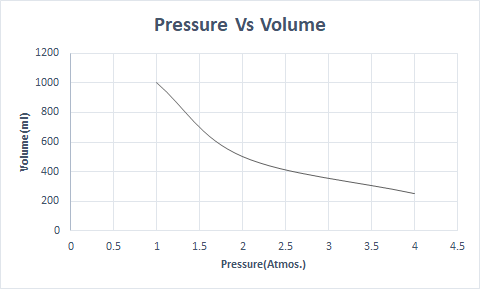
Daha yüksek rakımda, atmosferik basınç düşüktür, bu nedenle hava daha az yoğundur. Sonuç olarak, solunum için daha az oksijen mevcuttur. Dağcıların oksijen tüpü taşımalarının nedeni budur.
1787'de Jacques Charles, sıcaklığın sabit bir basınçta gaz halindeki bir maddenin hacmi üzerindeki etkisini inceledi. Charles Yasası, sabit basınç ve sabit kütlede bir gazın hacminin sıcaklıkla doğru orantılı olduğunu belirtir.
\(V ∝ T\)
\(V = yT\)
Burada y, gaz miktarına ve basınca bağlı olarak bir sabittir.
Charles Yasası şu şekilde ifade edilir:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Bu, sıcaklıktaki artışla hacmin artacağı anlamına gelir; sıcaklık azaldıkça hacim azalır. Deneyinde, belirli bir gaz kütlesinin hacminin, sıcaklıktaki her bir derecelik artış veya düşüşle orijinal hacminin 1/273,15 katı kadar arttığını veya azaldığını hesapladı.
Bu nedenle, eğer hacim 0 O C'de V 0 ise ve V t , t o C'deki hacim ise, o zaman,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
İşte Charles Yasasının grafiksel gösterimi:
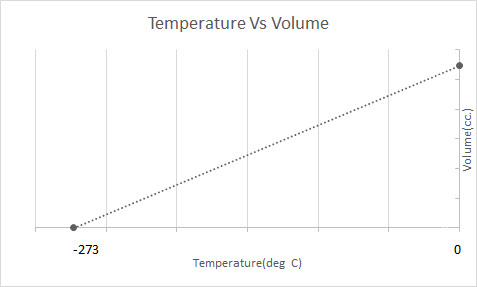
Sıcak hava balonları Charles Yasasına göre çalışır. Bir brülör balonun içinde hapsolmuş havayı ısıttığında, hava molekülleri daha hızlı hareket etmeye başlar ve genişler. Balonun içindeki gaz, onu çevreleyen havadan daha az yoğun hale gelerek daha fazla yer kaplar. Sıcak hava balonu daha az yoğun hale geldikçe yükselir ve yüzer.
Bu aynı zamanda Basınç Yasası olarak da bilinir. 1808 yılında Joseph Louis Gay-Lussac tarafından formüle edilmiştir.
Gay Lussac Yasası, sabit hacimde ideal bir gazın basıncının mutlak sıcaklığıyla (Kelvin cinsinden) doğru orantılı olduğunu belirtir.
\(P ∝ T\)
\(P/T = k \)
nerede
Gay-Lussac Yasası şu şekilde ifade edilebilir:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Neresi:
Gay-Lussac Yasasına göre, bir gazın basıncı (sabit hacimde tutulur), gaz sonunda yoğuşmaya uğrayıp sıvı hale gelene kadar soğutuldukça sürekli olarak azalır.
İşte Gay-Lussac Yasasının grafiksel gösterimi
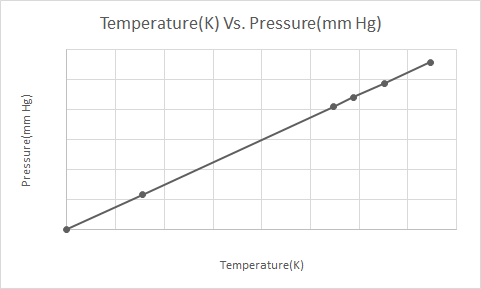
Basınçlı bir aerosol kutusu (örn. deodorant kutusu veya sprey boya kutusu) ısıtıldığında, gazların kap üzerine uyguladığı basınçta meydana gelen artış, bir patlamaya neden olabilir. Bu nedenle birçok basınçlı kapta, kabın ateşten uzak tutulması ve serin ortamda saklanması gerektiğini belirten uyarı etiketleri bulunur.
Düdüklü tencere ısıtıldığında, kabın içindeki buharın uyguladığı basınç artar. Kabın içindeki yüksek sıcaklık ve basınç, yiyeceğin daha hızlı pişmesine neden olur.