Існує три основних газових закони (закон Бойля, закон Чарльза та закон Авогадро), які описують взаємозв’язок тиску, температури, об’єму та кількості газу. На цьому уроці ми обговоримо наступне
Він названий на честь Роберта Бойля.
Це стверджує, що об’єм обернено пропорційний тиску, коли температура та кількість молекул постійні.
\(P ∝ 1/V\)
\(P = k_1V\)
де,
Р - тиск
V - це обсяг
і k 1 - константа пропорційності
Тепер, якщо фіксована маса газу зазнає розширення при постійній температурі, тоді кінцевий об’єм і тиск мають бути P 2 і V 2 .
Початковий об'єм і початковий тиск тут P 1 і V 1 , тоді згідно із законом Бойля:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Таким чином, при постійній температурі, якщо тиск збільшити вдвічі, об’єм цього газу зменшується вдвічі. У вільному стані газоподібна речовина займає більший об'єм ємності за рахунок розсіяних молекул. Коли на газоподібну речовину діє тиск, ці молекули зближуються і займають менший об’єм. Іншими словами, прикладений тиск прямо пропорційний щільності газу.
Ось графічне представлення закону Бойля:
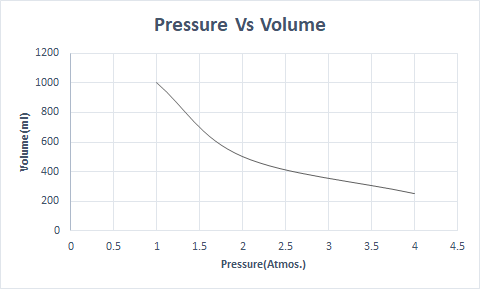
На більшій висоті атмосферний тиск низький, тому повітря менш щільне. У результаті стає менше кисню для дихання. Ось чому альпіністи носять кисневі балони.
У 1787 році Жак Шарль досліджував вплив температури на об’єм газоподібної речовини при постійному тиску. Закон Чарльза стверджує, що за постійного тиску та незмінної маси об’єм газу прямо пропорційний температурі.
\(V ∝ T\)
\(V = yT\)
Де y — константа, що залежить від кількості газу та тиску.
Закон Чарльза виражається так:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Це означає, що зі збільшенням температури об'єм буде збільшуватися; зі зниженням температури об'єм зменшується. У своєму експерименті він підрахував, що об’єм даної маси газу збільшується або зменшується в 1/273,15 рази від початкового об’єму з кожним підвищенням або зниженням температури відповідно.
Отже, якщо об’єм дорівнює V 0 при 0 ° C і V t є об’ємом при t o C, тоді
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Ось графічне представлення закону Чарльза:
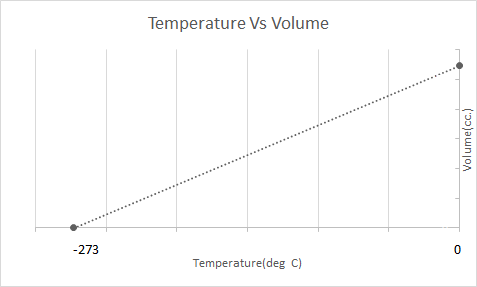
Повітряні кулі працюють на основі закону Чарльза. Коли пальник нагріває повітря, що потрапило всередину повітряної кулі, молекули повітря починають рухатися швидше та розширюються. Газ всередині повітряної кулі займає більше місця, стаючи менш щільним, ніж повітря, що його оточує. Коли повітряна куля стає менш щільною, вона піднімається вгору і плаває.
Це також відоме як закон тиску. Його сформулював Жозеф Луї Гей-Люссак у 1808 році.
Закон Гей-Люссака стверджує, що за постійного об’єму тиск ідеального газу прямо пропорційний його абсолютній температурі (у Кельвінах).
\(P ∝ T\)
\(P/T = k \)
де
Закон Гей-Люссака можна виразити так:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Де:
Відповідно до закону Гей-Люссака, тиск газу (при постійному об’ємі) постійно знижується, коли він охолоджується, доки газ остаточно не конденсується і не стане рідиною.
Ось графічне зображення закону Гей-Люссака
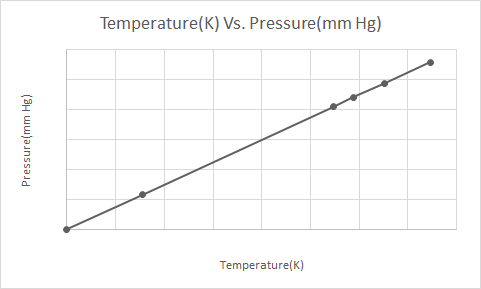
Коли аерозольний балон під тиском (наприклад, балончик з дезодорантом або балончик з фарбою) нагрівається, результуюче збільшення тиску газів на контейнер може призвести до вибуху. Це причина, чому багато контейнерів під тиском мають попереджувальні етикетки про те, що контейнер слід тримати подалі від вогню та зберігати в прохолодному середовищі.
Коли скороварка нагрівається, тиск пари всередині ємності зростає. Завдяки високій температурі та тиску всередині ємності їжа готується швидше.