گیس کے تین بنیادی قوانین (Boyle's Law, Charles' Law, and Avogadro's Law) ہیں جو دباؤ، درجہ حرارت، حجم اور گیس کی مقدار کے تعلق کو بیان کرتے ہیں۔ اس سبق میں، ہم مندرجہ ذیل بات کریں گے۔
اس کا نام رابرٹ بوائل کے نام پر رکھا گیا ہے۔
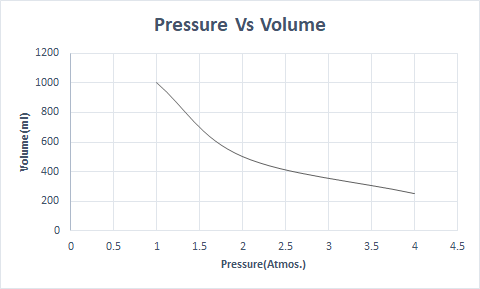
یہ بتاتا ہے کہ حجم دباؤ کے الٹا متناسب ہوتا ہے جب درجہ حرارت اور مالیکیولز کی تعداد مستقل ہوتی ہے۔
\(P ∝ 1/V\)
\(P = k_1V\)
کہاں،
P دباؤ ہے۔
V والیوم ہے۔
اور، k 1 تناسب مستقل ہے۔
اب، اگر گیس کا ایک مقررہ ماس مسلسل درجہ حرارت پر توسیع سے گزرتا ہے تو حتمی حجم اور دباؤ P 2 اور V 2 ہوگا۔
یہاں ابتدائی حجم اور ابتدائی دباؤ P 1 اور V 1 ہے، پھر Boyle کے قانون کے مطابق:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
اس طرح، ایک مستقل درجہ حرارت پر، اگر دباؤ کو دوگنا کر دیا جائے، تو اس گیس کا حجم آدھا رہ جاتا ہے۔ ایک آزاد حالت میں، ایک گیسی مادہ بکھرے ہوئے مالیکیولز کی وجہ سے کنٹینر کے بڑے حجم پر قابض ہوتا ہے۔ جب گیسی مادے پر دباؤ ڈالا جاتا ہے تو یہ مالیکیول قریب آتے ہیں اور کم حجم پر قبضہ کرتے ہیں۔ دوسرے الفاظ میں، لاگو دباؤ گیس کی کثافت کے براہ راست متناسب ہے.
بوائل کے قانون کی تصویری نمائندگی یہ ہے:
زیادہ اونچائی پر، ہوا کا دباؤ کم ہوتا ہے اس لیے ہوا کم گھنے ہوتی ہے۔ نتیجے کے طور پر، سانس لینے کے لئے کم آکسیجن دستیاب ہے. یہی وجہ ہے کہ کوہ پیما آکسیجن سلنڈر لے جاتے ہیں۔
1787 میں، جیک چارلس نے مسلسل دباؤ پر گیسی مادے کے حجم پر درجہ حرارت کے اثرات کا مطالعہ کیا۔ چارلس کا قانون کہتا ہے کہ مستقل دباؤ اور مسلسل بڑے پیمانے پر، گیس کا حجم درجہ حرارت کے براہ راست متناسب ہوتا ہے۔
\(V ∝ T\)
\(V = yT\)
جہاں y گیس اور پریشر کی مقدار کے لحاظ سے ایک مستقل ہے۔
چارلس کے قانون کا اظہار اس طرح کیا گیا ہے:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
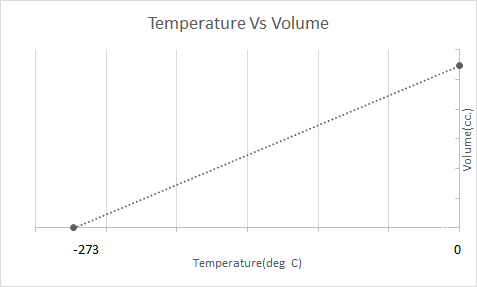
اس کا مطلب ہے کہ درجہ حرارت میں اضافے کے ساتھ حجم بڑھے گا۔ درجہ حرارت میں کمی کے ساتھ حجم کم ہو جاتا ہے۔ اپنے تجربے میں، اس نے حساب لگایا کہ درجہ حرارت میں بالترتیب ہر ڈگری کے اضافے یا گرنے کے ساتھ گیس کے دیے گئے بڑے پیمانے پر حجم اصل حجم کے 1/273.15 گنا بڑھتا یا گھٹتا ہے۔
لہذا، اگر حجم V 0 ہے 0 O C پر اور V t حجم ہے t o C پر تو،
\(V_t = V_0 + \frac{t}{273.15} V_0\)
یہاں چارلس کے قانون کی تصویری نمائندگی ہے:
گرم ہوا کے غبارے چارلس کے قانون کی بنیاد پر کام کرتے ہیں۔ جب برنر غبارے کے اندر پھنسی ہوا کو گرم کرتا ہے تو ہوا کے مالیکیول تیزی سے حرکت کرنا شروع کر دیتے ہیں اور پھیلتے ہیں۔ غبارے کے اندر موجود گیس زیادہ جگہ لیتی ہے، جو اس کے ارد گرد کی ہوا سے کم گھنے ہوتی ہے۔ جیسے جیسے گرم ہوا کا غبارہ کم گھنا ہوتا ہے، یہ اوپر اٹھتا ہے اور تیرتا ہے۔
اسے پریشر قانون بھی کہا جاتا ہے۔ اسے جوزف لوئس گی-لوساک نے 1808 میں وضع کیا تھا۔
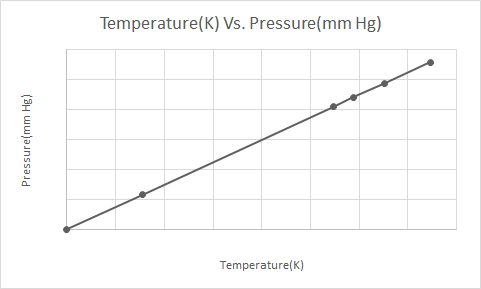
Gay Lussac کا قانون کہتا ہے کہ مستقل حجم پر، ایک مثالی گیس کا دباؤ اس کے مطلق درجہ حرارت (کیلون میں) کے براہ راست متناسب ہوتا ہے۔
\(P ∝ T\)
\(P/T = k \)
کہاں
ہم جنس پرستوں کے قانون کا اظہار اس طرح کیا جا سکتا ہے:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
کہاں:
Gay-Lussac کے قانون کے مطابق، گیس کا دباؤ (مستقل حجم پر رکھا جاتا ہے) مسلسل کم ہوتا ہے کیونکہ اسے ٹھنڈا کیا جاتا ہے جب تک کہ گیس بالآخر گاڑھا ہونے سے گزر کر مائع بن جاتی ہے۔
یہاں ہم جنس پرستوں کے قانون کی تصویری نمائندگی ہے۔
جب پریشرائزڈ ایروسول کین (مثلاً ڈیوڈورنٹ کین یا سپرے پینٹ کین) کو گرم کیا جاتا ہے، تو کنٹینر پر گیسوں کے دباؤ میں اضافے کے نتیجے میں دھماکہ ہو سکتا ہے۔ یہی وجہ ہے کہ بہت سے دباؤ والے کنٹینرز پر انتباہی لیبل ہوتے ہیں جس میں لکھا ہوتا ہے کہ کنٹینر کو آگ سے دور رکھنا چاہیے اور اسے ٹھنڈے ماحول میں رکھنا چاہیے۔
جب پریشر ککر کو گرم کیا جاتا ہے تو کنٹینر کے اندر بھاپ کے ذریعے دباؤ بڑھ جاتا ہے۔ کنٹینر کے اندر زیادہ درجہ حرارت اور دباؤ کھانے کو تیزی سے پکنے کا سبب بنتا ہے۔