Gazning bosimi, harorati, hajmi va miqdori o‘rtasidagi bog‘liqlikni tavsiflovchi uchta asosiy gaz qonuni (Boyl qonuni, Charlz qonuni va Avogadro qonuni) mavjud. Ushbu darsda biz quyidagilarni muhokama qilamiz
U Robert Boyl sharafiga nomlangan.
Bu shuni ko'rsatadiki, harorat va molekulalar soni doimiy bo'lganda hajm bosimga teskari proportsionaldir.
\(P ∝ 1/V\)
\(P = k_1V\)
qayerda,
P - bosim
V - hajm
va, k 1 - proportsionallik doimiysi
Endi, agar gazning qattiq massasi doimiy haroratda kengayishga duchor bo'lsa, u holda yakuniy hajm va bosim P 2 va V 2 bo'lishi kerak.
Bu erda boshlang'ich hajm va dastlabki bosim P 1 va V 1 , keyin Boyl qonuniga ko'ra:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Shunday qilib, doimiy haroratda, agar bosim ikki baravar oshirilsa, bu gazning hajmi yarmigacha kamayadi. Erkin holatda gazsimon modda tarqalgan molekulalar tufayli idishning katta hajmini egallaydi. Gazsimon moddaga bosim o'tkazilsa, bu molekulalar yaqinlashadi va kamroq hajmni egallaydi. Boshqacha qilib aytganda, qo'llaniladigan bosim gazning zichligiga to'g'ridan-to'g'ri proportsionaldir.
Mana Boyl qonunining grafik tasviri:
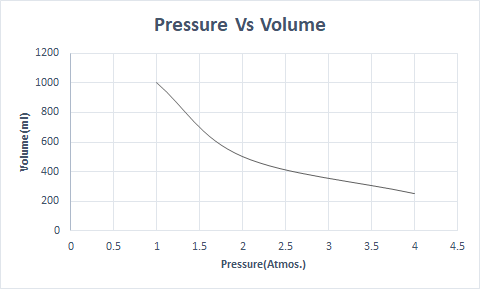
Yuqori balandlikda atmosfera bosimi past bo'ladi, shuning uchun havo kamroq zichroq. Natijada nafas olish uchun kamroq kislorod mavjud. Shuning uchun alpinistlar kislorod ballonlarini olib yurishadi.
1787 yilda Jak Charlz doimiy bosimdagi gazsimon moddaning hajmiga haroratning ta'sirini o'rgandi. Charlz qonunida aytilishicha, doimiy bosim va doimiy massada gaz hajmi haroratga to'g'ridan-to'g'ri proportsionaldir.
\(V ∝ T\)
\(V = yT\)
Bu erda y - gaz miqdori va bosimga bog'liq doimiy.
Charlz qonuni quyidagicha ifodalanadi:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Bu shuni anglatadiki, harorat oshishi bilan hajm oshadi; haroratning pasayishi bilan hajm kamayadi. U o'z tajribasida ma'lum bir gaz massasining hajmi haroratning har bir darajaga ko'tarilishi yoki pasayishi bilan dastlabki hajmning 1/273,15 marta ortishi yoki kamayishini hisoblab chiqdi.
Shuning uchun, agar 0 O C da tovush V 0 bo'lsa va V t t o C da hajm bo'lsa, u holda,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Mana Charlz qonunining grafik tasviri:
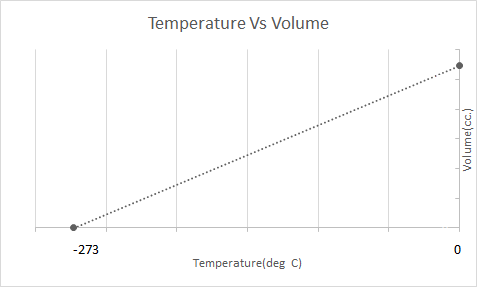
Issiq havo sharlari Charlz qonuni asosida ishlaydi. Brülör balon ichidagi havoni qizdirganda, havo molekulalari tezroq harakatlana boshlaydi va kengayadi. Balon ichidagi gaz ko'proq joy egallaydi va uni o'rab turgan havodan kamroq zichroq bo'ladi. Issiq havo shari kamroq zichroq bo'lganda, u yuqoriga ko'tariladi va suzadi.
Bu bosim qonuni sifatida ham tanilgan. U 1808 yilda Jozef Lui Gey-Lyusak tomonidan ishlab chiqilgan.
Gey Lussak qonunida aytilishicha, doimiy hajmda ideal gazning bosimi uning mutlaq haroratiga to'g'ridan-to'g'ri proportsionaldir (Kelvinda).
\(P ∝ T\)
\(P/T = k \)
qayerda
Gey-Lyussak qonuni quyidagicha ifodalanishi mumkin:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Qayerda:
Gay-Lyussak qonuniga ko'ra, gazning bosimi (doimiy hajmda saqlanadi) soviganida, gaz oxir-oqibat kondensatsiyaga uchraguncha va suyuqlikka aylanmaguncha doimiy ravishda pasayadi.
Bu erda Gey-Lyussak qonunining grafik tasviri
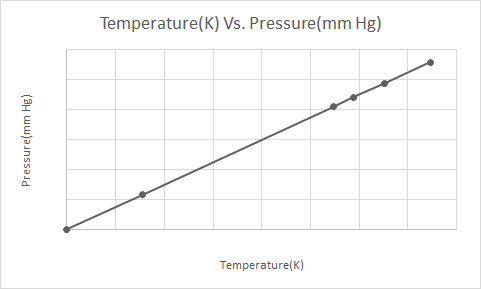
Bosim ostidagi aerozol idishi (masalan, dezodorant yoki purkagichli bo'yoq idishi) qizdirilganda, idishdagi gazlar tomonidan bosimning oshishi natijasida portlash sodir bo'lishi mumkin. Shuning uchun ko'plab bosimli idishlarda idishni olovdan uzoqroq saqlash va salqin muhitda saqlash kerakligi haqida ogohlantiruvchi yorliqlar mavjud.
Bosimli pishirgich qizdirilganda, idish ichidagi bug'ning bosimi ortadi. Idish ichidagi yuqori harorat va bosim ovqatning tezroq pishishiga olib keladi.