Có ba định luật khí cơ bản (Luật Boyle, Định luật Charles và Định luật Avogadro) mô tả mối quan hệ của áp suất, nhiệt độ, thể tích và lượng khí. Trong bài học này, chúng ta sẽ thảo luận về những điều sau đây
Nó được đặt theo tên của Robert Boyle.
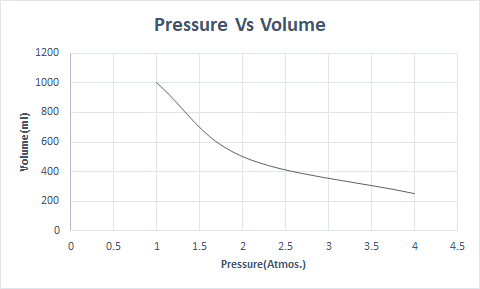
Điều này nói rằng thể tích tỷ lệ nghịch với áp suất khi nhiệt độ và số lượng phân tử không đổi.
\(P ∝ 1/V\)
\(P = k_1V\)
ở đâu,
P là áp suất
V là Khối lượng
và, k 1 là hằng số tỷ lệ
Bây giờ, nếu một khối khí cố định giãn nở ở nhiệt độ không đổi thì thể tích và áp suất cuối cùng sẽ là P 2 và V 2 .
Thể tích ban đầu và áp suất ban đầu ở đây là P 1 và V 1 , sau đó theo định luật Boyle:
\(P_1 \times V_1 = P_2 \times V_2 =constant (k_1) \)
\(or,\frac{P_1}{P_2} = \frac{V_2}{V_1} \)
Như vậy, ở nhiệt độ không đổi, nếu tăng áp suất lên gấp đôi thì thể tích của lượng khí đó giảm đi một nửa. Ở trạng thái tự do, chất khí chiếm thể tích lớn hơn bình chứa do các phân tử phân tán. Khi áp suất tác dụng lên chất khí, các phân tử này tiến lại gần hơn và chiếm một thể tích nhỏ hơn. Nói cách khác, áp suất tác dụng tỷ lệ thuận với mật độ của khí.
Đây là biểu diễn đồ họa của Định luật Boyle:
Ở độ cao lớn hơn, áp suất khí quyển thấp nên không khí ít đậm đặc hơn. Kết quả là, có ít oxy hơn để thở. Đây là lý do những người leo núi mang theo bình oxy.
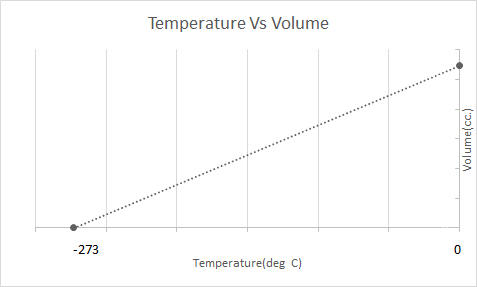
Năm 1787, Jacques Charles đã nghiên cứu ảnh hưởng của nhiệt độ đến thể tích của một chất khí ở áp suất không đổi. Định luật Charles phát biểu rằng ở áp suất không đổi và khối lượng không đổi, thể tích của một chất khí tỷ lệ thuận với nhiệt độ.
\(V ∝ T\)
\(V = yT\)
Trong đó y là hằng số phụ thuộc vào lượng khí và áp suất.
Định luật Charles được thể hiện như sau:
\(\frac{V_1}{T_1} = \frac{V_2}{T_2}\)
Điều này có nghĩa là với sự gia tăng nhiệt độ, âm lượng sẽ tăng lên; nhiệt độ giảm thì thể tích giảm. Trong thí nghiệm của mình, ông đã tính toán được rằng thể tích của một lượng khí nhất định tăng hoặc giảm 1/273,15 lần so với thể tích ban đầu với mỗi độ tăng hoặc giảm nhiệt độ tương ứng.
Do đó, nếu thể tích là V 0 ở 0 O C và V t là thể tích ở t o C thì,
\(V_t = V_0 + \frac{t}{273.15} V_0\)
Đây là biểu diễn đồ họa của Định luật Charles:
Khinh khí cầu hoạt động dựa trên định luật Charles. Khi một đầu đốt đốt nóng không khí bị mắc kẹt bên trong quả bóng bay, các phân tử không khí bắt đầu chuyển động nhanh hơn và nở ra. Khí bên trong quả bóng chiếm nhiều không gian hơn, trở nên ít đậm đặc hơn không khí xung quanh nó. Khi khinh khí cầu trở nên ít đậm đặc hơn, nó bay lên và lơ lửng.
Điều này còn được gọi là Luật áp lực. Nó được xây dựng bởi Joseph Louis Gay-Lussac vào năm 1808.
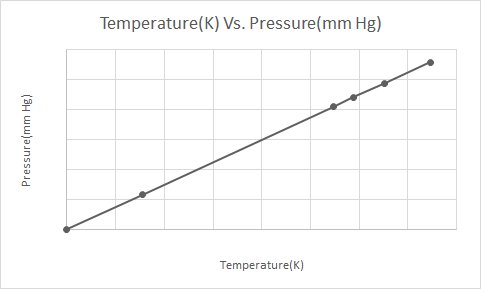
Định luật Gay Lussac phát biểu rằng ở thể tích không đổi, áp suất của một loại khí lý tưởng tỷ lệ thuận với nhiệt độ tuyệt đối của nó (tính bằng Kelvin).
\(P ∝ T\)
\(P/T = k \)
ở đâu
Định luật Gay-Lussac có thể được biểu diễn như sau:
\(\frac{P_1}{T_1} = \frac{P_2}{T_2}\)
Ở đâu:
Theo Định luật Gay-Lussac, áp suất của một chất khí (được giữ ở thể tích không đổi) giảm liên tục khi nó được làm lạnh cho đến khi chất khí cuối cùng trải qua quá trình ngưng tụ và trở thành chất lỏng.
Đây là biểu diễn đồ họa của Luật Gay-Lussac
Khi một bình xịt có áp suất (ví dụ như bình xịt khử mùi hoặc bình xịt sơn) được làm nóng, dẫn đến sự gia tăng áp suất do khí tác dụng lên bình chứa có thể dẫn đến một vụ nổ. Đây là lý do tại sao nhiều bình chứa áp suất có nhãn cảnh báo rằng bình chứa phải được tránh xa lửa và được bảo quản trong môi trường mát mẻ.
Khi nồi áp suất được làm nóng, áp suất do hơi nước bên trong nồi tạo ra sẽ tăng lên. Nhiệt độ và áp suất bên trong hộp cao giúp thức ăn chín nhanh hơn.