سوف تتعلم :
الجزيء عبارة عن مجموعة من ذرتين أو أكثر متصلين كيميائيًا معًا. على سبيل المثال ، تتحد ذرتان من الهيدروجين لتكوين جزيء من الهيدروجين. وبالمثل ، تتحد ذرة واحدة من الصوديوم مع ذرة واحدة من الكلور لتكوين جزيء من كلوريد الصوديوم. يمكننا أيضًا أن نقول ، إن الجزيء هو أصغر جسيم لعنصر أو مركب قادر على الوجود المستقل ويظهر جميع خصائص هذا العنصر أو المركب.
يمكننا تقسيم الجزيئات إلى جزيئات من العناصر وجزيئات المركبات .
تتكون جزيئات العنصر من نفس النوع من الذرات. تتكون جزيئات بعض العناصر مثل الهيليوم (He) من ذرة واحدة فقط من هذا العنصر. لكن ذرات عناصر مثل الأكسجين والنيتروجين وما إلى ذلك لا يمكن أن توجد بشكل مستقل.
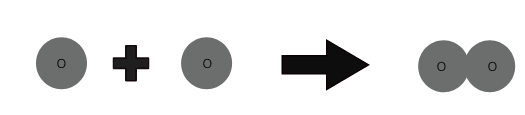
1 ذرة أكسجين + 1 ذرة أكسجين ⇒ 1 جزيء أكسجين
يسمى عدد الذرات الموجودة في جزيء عنصر ما ذريته. يمكن أن تكون الذرية أحادية الذرة وثنائية الذرة وثلاثية الذرات ومتعددة الذرات.
| الذرية | عدد الذرات | أمثلة |
| أحادي الذرة | 1 | الغازات النبيلة مثل الهليوم ( \(He\) ) ، النيون ( \(Ne\) ) |
| ثنائي الذرة | 2 | الهيدروجين ( \(H_2\) ) الكلور ( \(Cl_2\) ) |
| ثلاثي الذرات | 3 | الأوزون ( \(O_3\) ) |
| متعدد الذرات | > 2 | الفوسفور ( \(P_4\) ) الذرية 4 الكبريت ( \(S_8\) ) الذرية 8 |
يشير المركب الكيميائي إلى مادة كيميائية تتكون من العديد من الجزيئات المتطابقة التي تتكون من ذرات من أكثر من عنصر واحد متصل ببعضه البعض بواسطة روابط كيميائية. ذرتان من نفس العنصر مرتبطان في جزيء لا يشكلان مركبًا كيميائيًا ، وذلك لأن هذا يتطلب عنصرين مختلفين.
معظم المواد الموجودة في الطبيعة - مثل الخشب والتربة والصخور - عبارة عن خليط من المركبات الكيميائية.
السمة المميزة للمركب هو أن له صيغة كيميائية. تصف الصيغ نسبة الذرات في المادة. على سبيل المثال ، صيغة جزيء الماء هي H 2 O. وهذا يشير إلى أن ذرتين من الهيدروجين مرتبطة بذرة أكسجين واحدة.
تتحد ذرات العناصر المختلفة معًا بنسبة محددة لتكوين جزيئات من المركبات. على سبيل المثال ، يمثل الماء ( \(H_2O\) ) جزيء الماء المركب حيث تتحد ذرتان من الهيدروجين مع ذرة واحدة من الأكسجين.
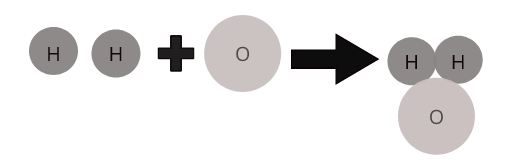
جزيئات بعض المركبات الشائعة:
| مُجَمَّع | الجمع بين العناصر |
| كلوريد الهيدروجين ( \(HCl\) ) | الهيدروجين والكلور |
| ماء ( \(H_2O\) ) | الهيدروجين والأكسجين |
| ثاني أكسيد الكربون ( \(CO_2\) ) | الكربون والأكسجين |
عندما تقترب الذرات من بعضها ، فإنها تتحد لتشكل جزيئات. عندما تتحد ، تعطي ذرة واحدة أو تتبرع بإلكترون واحد أو أكثر تقبله الذرات الأخرى. نتيجة لذلك ، يتم تكوين رابطة كيميائية تجمع الذرات معًا لتكوين مركب.
التكافؤ هو عدد الإلكترونات التي يمكن للذرة أن تشير إليها أو تقبلها لتشكيل مركب كيميائي أو جزيئات مع ذرة أخرى. إنها القدرة المجمعة لذرة عنصر.
التكافؤ هو دائمًا عدد صحيح. تسمى العناصر ذات التكافؤ 1 أحادية التكافؤ. تسمى العناصر ذات التكافؤ 2 ثنائية التكافؤ وتسمى التكافؤ الذي يساوي 3 باسم ثلاثي التكافؤ. العديد من العناصر لها تكافؤ متغير (أكثر من تكافؤ واحد). يتم كتابة العنصر الذي يحتوي على أكثر من تكافؤ كاسم العنصر متبوعًا برقم روماني بين قوسين للإشارة إلى التكافؤ. على سبيل المثال ، تتم كتابة النحاس مع التكافؤ 1 بالنحاس [I]
عناصر قليلة وتكافؤهم:
| عنصر | تكافؤ |
| الهيدروجين ( \(H\) ) | 1 |
| الهليوم ( \(He\) ) | 0 |
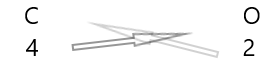
| كربون ( \(C\) ) | 4 |
| نيتروجين ( \(N\) ) | 3 |
| الأكسجين ( \(O\) ) | 2 |
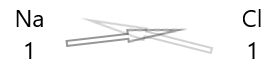
| صوديوم ( \(Na\) ) | 1 |
| المغنيسيوم ( \(Mg\) ) | 2 |
| الفوسفور ( \(P\) ) | 3 |
| الكبريت ( \(S\) ) | 2 |
| الكلور ( \(Cl\) ) | 1 |
| البوتاسيوم ( \(K\) ) | 1 |
| الكالسيوم ( \(Ca\) ) | 2 |
| النحاس ( \(Cu\) ) | 1 2 |
| حديد ( \(Fe\) ) | 2 3 |
الصيغة الكيميائية للمركب هي تمثيل رمزي لتكوينه. يخبرنا عدد ذرات العناصر المختلفة الموجودة في جزيء واحد من المركب.
قواعد لكتابة صيغة المركب:
1 . اكتب رمز العناصر وتكافؤهم تحتها.
2. تبادل التكافؤ بهم وكتابتها على شكل رموز.
3. إذا كانت التكافؤات في الصيغة الكيميائية قابلة للقسمة على أي عامل ، فقم بقسمة وتبسيط.
تظهر المركبات الكيميائية مجموعة محيرة من الخصائص. في درجات الحرارة والضغوط العادية ، يكون بعضها صلبة وبعضها سوائل وبعضها غازات. المركبات الكيميائية ذات ألوان متنوعة. بعض المركبات شديدة السمية للإنسان ، في حين أن البعض الآخر ضروري للحياة. قد يكون استبدال ذرة واحدة فقط داخل المركب مسؤولاً عن تغيير اللون أو الرائحة أو السمية للمادة.