Siz öyrənəcəksiniz :
Molekul kimyəvi cəhətdən birləşmiş iki və ya daha çox atomdan ibarət qrupdur. Məsələn, iki hidrogen atomu birləşərək hidrogen molekulunu əmələ gətirir. Eynilə, bir natrium atomu bir xlor atomu ilə birləşərək natrium xlorid molekulunu əmələ gətirir. Həmçinin deyə bilərik ki, molekul bir elementin və ya birləşmənin müstəqil mövcud ola bilən və həmin elementin və ya birləşmənin bütün xüsusiyyətlərini göstərən ən kiçik hissəcikdir.
Molekulları elementlərin molekullarına və birləşmələrin molekullarına bölmək olar.
Elementin molekulları eyni tip atomlardan ibarətdir. Helium (He) kimi bəzi elementlərin molekulları həmin elementin yalnız bir atomundan ibarətdir. Lakin oksigen, azot və s. kimi elementlərin atomları müstəqil mövcud ola bilməz.
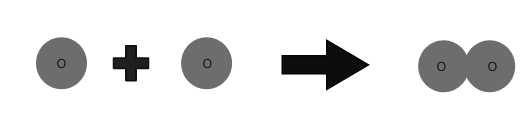
1 oksigen atomu + 1 oksigen atomu ⇒ 1 oksigen molekulu
Bir elementin molekulunda mövcud olan atomların sayı onun atomluğu adlanır. Atomluq bir atomlu, iki atomlu, üç atomlu və çox atomlu ola bilər .
| Atomluq | Atomların sayı | Nümunələr |
| Monoatomik | 1 | Helium( \(He\) ), Neon ( \(Ne\) ) kimi nəcib qazlar |
| Diatomik | 2 | Hidrogen( \(H_2\) ) Xlor ( \(Cl_2\) ) |
| Üç atomlu | 3 | Ozon ( \(O_3\) ) |
| Çox atomlu | > 2 | Fosfor ( \(P_4\) ) Atomluq 4 Kükürd( \(S_8\) ) Atomluq 8 |
Kimyəvi birləşmə kimyəvi bağlarla birləşən birdən çox elementin atomlarından ibarət çoxlu eyni molekullardan ibarət kimyəvi maddəyə aiddir. Bir molekulda bağlanmış eyni elementdən iki atom kimyəvi birləşmə əmələ gətirmir, çünki bunun üçün iki fərqli element lazımdır.
Təbiətdə tapılan maddələrin əksəriyyəti - ağac, torpaq və qayalar kimi - kimyəvi birləşmələrin qarışıqlarıdır.
Bir birləşmənin müəyyənedici xüsusiyyəti onun kimyəvi formulunun olmasıdır. Formulalar maddədəki atomların nisbətini təsvir edir. Məsələn, su molekulunun düsturu H 2 O-dur. bu, iki hidrogen atomunun bir oksigen atomuna bağlı olduğunu göstərir.
Müxtəlif elementlərin atomları müəyyən nisbətdə birləşərək birləşmələrin molekullarını əmələ gətirir. Məsələn, su ( \(H_2O\) ) iki hidrogen atomunun bir oksigen atomu ilə birləşdiyi mürəkkəb suyun molekulunu təmsil edir.
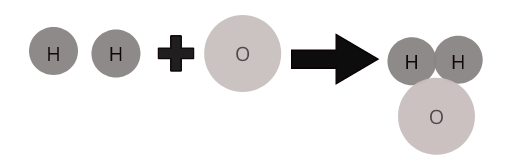
Bəzi ümumi birləşmələrin molekulları:
| Qarışıq | Elementlərin birləşməsi |
| Hidrogen xlorid ( \(HCl\) ) | Hidrogen, Xlor |
| Su ( \(H_2O\) ) | Hidrogen, Oksigen |
| Karbon qazı ( \(CO_2\) ) | Karbon, Oksigen |
Atomlar bir-birinə yaxınlaşdıqda birləşərək molekullar əmələ gətirirlər. Onlar birləşdikdə, bir atom digər atomlar tərəfindən qəbul edilən bir və ya bir neçə elektron verir və ya verir. Nəticədə, birləşmə yaratmaq üçün atomları birləşdirən kimyəvi bir əlaqə yaranır.
Valentlik bir atomun başqa bir atomla kimyəvi birləşmə və ya molekullar yaratmaq üçün işarə edə və ya qəbul edə biləcəyi elektronların sayıdır. Bir element atomunun birləşmə qabiliyyətidir.
Valentlik həmişə tam ədəddir. Valentliyi 1 olan elementlərə monovalent deyilir. Valentliyi 2 olan elementlər ikivalentli , 3-ə bərabər olan elementlər isə üçvalentli adlanır. Bir çox elementlərin dəyişən valentliyi var (birdən çox valentlik). Birdən çox valentliyi olan element elementin adı kimi yazılır və valentliyi göstərmək üçün mötərizədə Roma rəqəmi qoyulur. Məsələn, valentliyi 1 olan mis Mis[I] kimi yazılır.
Bir neçə element və onların valentliyi:
| Element | Valentlik |
| Hidrogen ( \(H\) ) | 1 |
| Helium( \(He\) ) | 0 |
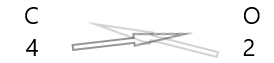
| Karbon( \(C\) ) | 4 |
| Azot ( \(N\) ) | 3 |
| Oksigen( \(O\) ) | 2 |
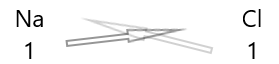
| Natrium ( \(Na\) ) | 1 |
| Maqnezium ( \(Mg\) ) | 2 |
| Fosfor ( \(P\) ) | 3 |
| Kükürd ( \(S\) ) | 2 |
| Xlor( \(Cl\) ) | 1 |
| Kalium ( \(K\) ) | 1 |
| Kalsium ( \(Ca\) ) | 2 |
| Mis( \(Cu\) ) | 1 2 |
| Dəmir( \(Fe\) ) | 2 3 |
Bir birləşmənin kimyəvi formulu onun tərkibinin simvolik ifadəsidir. Bu bizə birləşmənin bir molekulunda mövcud olan müxtəlif elementlərin atomlarının sayını bildirir.
Bir birləşmənin düsturunu yazmaq qaydaları:
1 . Aşağıda elementlərin simvolunu və onların valentliyini yazın.
2. Onların valentliyini dəyişdirin və onları alt işarə kimi yazın.
3. Kimyəvi düsturdakı valentliklər hər hansı amilə bölünürsə, bölün və sadələşdirin.
Kimyəvi birləşmələr heyrətləndirici xüsusiyyətlər nümayiş etdirir. Adi temperatur və təzyiqlərdə bəziləri bərk, bəziləri maye, bəziləri isə qaz halında olur. Kimyəvi birləşmələr müxtəlif rənglərdə olur. Bəzi birləşmələr insanlar üçün çox zəhərlidir, digərləri isə həyat üçün vacibdir. Bir birləşmədə yalnız bir atomun əvəz edilməsi maddənin rənginin, qoxusunun və ya toksikliyinin dəyişməsinə cavabdeh ola bilər.