আপনি শিখবেন :
একটি অণু হল দুই বা ততোধিক পরমাণুর একটি দল যা রাসায়নিকভাবে একত্রিত হয়। উদাহরণস্বরূপ, হাইড্রোজেনের দুটি পরমাণু একত্রিত হয়ে হাইড্রোজেনের একটি অণু তৈরি করে। একইভাবে, সোডিয়ামের একটি পরমাণু ক্লোরিনের একটি পরমাণুর সাথে একত্রিত হয়ে সোডিয়াম ক্লোরাইডের একটি অণু তৈরি করে। আমরা আরও বলতে পারি, একটি অণু হল একটি মৌল বা যৌগের ক্ষুদ্রতম কণা যা স্বাধীন অস্তিত্বে সক্ষম এবং সেই উপাদান বা যৌগের সমস্ত বৈশিষ্ট্য দেখায়।
আমরা অণুকে উপাদানের অণু এবং যৌগের অণুতে ভাগ করতে পারি।
একটি মৌলের অণু একই ধরনের পরমাণু দিয়ে তৈরি। কিছু উপাদানের অণু যেমন হিলিয়াম (He) সেই মৌলের একটি মাত্র পরমাণু দিয়ে তৈরি। কিন্তু অক্সিজেন, নাইট্রোজেন ইত্যাদি উপাদানের পরমাণু স্বাধীনভাবে থাকতে পারে না।
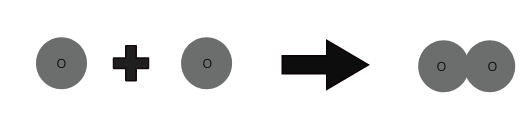
1 অক্সিজেন পরমাণু + 1 অক্সিজেন পরমাণু ⇒ 1 অক্সিজেন অণু
একটি উপাদানের একটি অণুতে উপস্থিত পরমাণুর সংখ্যাকে এর পারমাণবিকতা বলে। পারমাণবিকতা একপরমাণু, ডায়াটমিক, ট্রায়াটমিক এবং পলিএটমিক হতে পারে ।
| পারমাণবিকতা | পরমাণুর সংখ্যা | উদাহরণ |
| একপরমাণু | 1 | নোবেল গ্যাস যেমন হিলিয়াম ( \(He\) ), নিয়ন ( \(Ne\) ) |
| ডায়াটমিক | 2 | হাইড্রোজেন( \(H_2\) ) ক্লোরিন ( \(Cl_2\) ) |
| ট্রায়াটমিক | 3 | ওজোন( \(O_3\) ) |
| পল্যাটমিক | > 2 | ফসফরাস( \(P_4\) ) পারমাণবিকতা 4 সালফার( \(S_8\) ) পারমাণবিকতা 8 |
একটি রাসায়নিক যৌগ একটি রাসায়নিক পদার্থকে বোঝায় যা অনেকগুলি অভিন্ন অণু দ্বারা গঠিত যা রাসায়নিক বন্ধনের দ্বারা একত্রিত একাধিক উপাদান থেকে পরমাণু দ্বারা গঠিত। একটি অণুতে আবদ্ধ একই উপাদান থেকে দুটি পরমাণু একটি রাসায়নিক যৌগ গঠন করে না, কারণ এর জন্য দুটি ভিন্ন উপাদানের প্রয়োজন হয়।
প্রকৃতিতে পাওয়া বেশিরভাগ পদার্থ - যেমন কাঠ, মাটি এবং শিলা - রাসায়নিক যৌগের মিশ্রণ।
একটি যৌগের একটি সংজ্ঞায়িত বৈশিষ্ট্য হল যে এটির একটি রাসায়নিক সূত্র রয়েছে। সূত্র একটি পদার্থে পরমাণুর অনুপাত বর্ণনা করে। উদাহরণস্বরূপ, একটি জলের অণুর সূত্র হল H 2 O। এটি নির্দেশ করে যে দুটি হাইড্রোজেন পরমাণু একটি অক্সিজেন পরমাণুর সাথে বন্ধনে আবদ্ধ।
বিভিন্ন উপাদানের পরমাণু একটি নির্দিষ্ট অনুপাতে একত্রিত হয়ে যৌগের অণু তৈরি করে। উদাহরণস্বরূপ, জল ( \(H_2O\) ) যৌগিক জলের একটি অণুকে প্রতিনিধিত্ব করে যেখানে হাইড্রোজেনের দুটি পরমাণু অক্সিজেনের একটি পরমাণুর সাথে একত্রিত হয়।
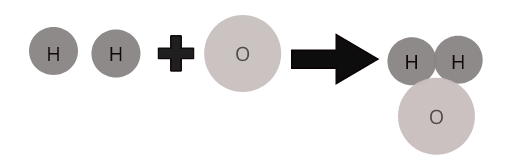
কিছু সাধারণ যৌগের অণু:
| যৌগ | উপাদান সমন্বয় |
| হাইড্রোজেন ক্লোরাইড ( \(HCl\) ) | হাইড্রোজেন, ক্লোরিন |
| জল ( \(H_2O\) ) | হাইড্রোজেন, অক্সিজেন |
| কার্বন ডাই অক্সাইড ( \(CO_2\) ) | কার্বন, অক্সিজেন |
যখন পরমাণু একে অপরের কাছাকাছি আসে, তখন তারা একত্রিত হয়ে অণু তৈরি করে। যখন তারা একত্রিত হয়, একটি পরমাণু এক বা একাধিক ইলেকট্রন দেয় বা দান করে যা অন্য পরমাণু দ্বারা গৃহীত হয়। ফলস্বরূপ, একটি রাসায়নিক বন্ধন গঠিত হয় যা পরমাণুগুলিকে একত্রিত করে যৌগ গঠন করে।
ভ্যালেন্সি হল ইলেকট্রনের সংখ্যা যা একটি পরমাণু অন্য একটি পরমাণুর সাথে একটি রাসায়নিক যৌগ বা অণু গঠন করতে বোঝাতে বা গ্রহণ করতে পারে। এটি একটি উপাদানের একটি পরমাণুর সমন্বয় ক্ষমতা।
একটি ভ্যালেন্সি সর্বদা একটি পূর্ণ সংখ্যা। ভ্যালেন্সি 1 সহ মৌলগুলিকে মনোভ্যালেন্ট বলা হয় । ভ্যালেন্সি 2 যুক্ত উপাদানগুলিকে বলা হয় দ্বৈত এবং 3-এর সমমূল্যকে ত্রিভ্যালেন্ট বলা হয় । অনেক উপাদানের পরিবর্তনশীল ভ্যালেন্সি থাকে (একের বেশি ভ্যালেন্সি)। একাধিক ভ্যালেন্সি সহ একটি উপাদানকে উপাদানের নাম হিসাবে লিখিত হয় তারপরে বন্ধনীতে একটি রোমান সংখ্যা থাকে যা ভ্যালেন্সি নির্দেশ করে। উদাহরণস্বরূপ, ভ্যালেন্সি 1 সহ তামাকে কপার [I] হিসাবে লেখা হয়
কয়েকটি উপাদান এবং তাদের ভ্যালেন্সি:
| উপাদান | ভ্যালেন্সি |
| হাইড্রোজেন ( \(H\) ) | 1 |
| হিলিয়াম( \(He\) ) | 0 |
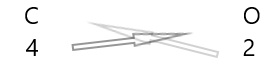
| কার্বন( \(C\) ) | 4 |
| নাইট্রোজেন( \(N\) ) | 3 |
| অক্সিজেন( \(O\) ) | 2 |
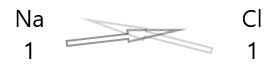
| সোডিয়াম( \(Na\) ) | 1 |
| ম্যাগনেসিয়াম ( \(Mg\) ) | 2 |
| ফসফরাস( \(P\) ) | 3 |
| সালফার ( \(S\) ) | 2 |
| ক্লোরিন ( \(Cl\) ) | 1 |
| পটাসিয়াম ( \(K\) ) | 1 |
| ক্যালসিয়াম( \(Ca\) ) | 2 |
| তামা( \(Cu\) ) | 1 2 |
| আয়রন( \(Fe\) ) | 2 3 |
একটি যৌগের রাসায়নিক সূত্র হল তার গঠনের প্রতীকী উপস্থাপনা। এটি আমাদের একটি যৌগের একটি অণুতে উপস্থিত বিভিন্ন উপাদানের পরমাণুর সংখ্যা বলে।
যৌগের সূত্র লেখার নিয়ম:
1 উপাদানগুলির প্রতীক এবং তাদের নীচে তাদের ভ্যালেন্সি লিখ।
2. তাদের ভ্যালেন্সি বিনিময় করুন এবং সাবস্ক্রিপ্ট হিসাবে লিখুন।
3. রাসায়নিক সূত্রের ভ্যালেন্সিগুলো যদি কোনো গুণনীয়ক দ্বারা বিভাজ্য হয়, তাহলে ভাগ করুন এবং সরলীকরণ করুন।
রাসায়নিক যৌগ বৈশিষ্ট্যের একটি বিস্ময়কর অ্যারে দেখায়। সাধারণ তাপমাত্রা এবং চাপে, কিছু কঠিন, কিছু তরল এবং কিছু গ্যাস। রাসায়নিক যৌগগুলি বিভিন্ন রঙের হয়। কিছু যৌগ মানুষের জন্য অত্যন্ত বিষাক্ত, অন্যগুলি জীবনের জন্য অপরিহার্য। একটি যৌগের মধ্যে শুধুমাত্র একটি একক পরমাণুর প্রতিস্থাপন একটি পদার্থের রঙ, গন্ধ বা বিষাক্ততা পরিবর্তনের জন্য দায়ী হতে পারে।