Aprenderás :
Una molécula es un grupo de dos o más átomos que se unen químicamente. Por ejemplo, dos átomos de hidrógeno se combinan para formar una molécula de hidrógeno. De manera similar, un átomo de sodio se combina con un átomo de cloro para formar una molécula de cloruro de sodio. También podemos decir que una molécula es la partícula más pequeña de un elemento o compuesto que es capaz de existir de forma independiente y muestra todas las propiedades de ese elemento o compuesto.
Podemos dividir las moléculas en moléculas de elementos y moléculas de compuestos .
Las moléculas de un elemento están hechas del mismo tipo de átomos. Las moléculas de algunos elementos como el helio (He) están formadas por un solo átomo de ese elemento. Pero los átomos de elementos como el oxígeno, el nitrógeno, etc. no pueden existir de forma independiente.
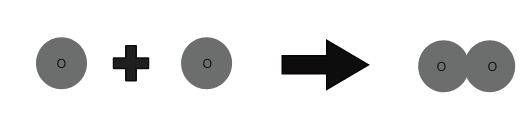
1 átomo de oxígeno + 1 átomo de oxígeno ⇒ 1 molécula de oxígeno
El número de átomos presentes en una molécula de un elemento se llama su atomicidad. La atomicidad puede ser monoatómica, diatómica, triatómica y poliatómica.
| Atomicidad | Número de átomos | Ejemplos |
| monoatómico | 1 | Gases nobles como helio ( \(He\) ), neón ( \(Ne\) ) |
| Diatónico | 2 | Hidrógeno( \(H_2\) ) Cloro( \(Cl_2\) ) |
| triatómico | 3 | Ozono( \(O_3\) ) |
| poliatómico | > 2 | Fósforo( \(P_4\) ) Atomicidad 4 Azufre( \(S_8\) ) Atomicidad 8 |
Un compuesto químico se refiere a una sustancia química que se compone de muchas moléculas idénticas que se componen de átomos de más de un elemento unidos por enlaces químicos. Dos átomos de un mismo elemento unidos en una molécula no forman un compuesto químico, esto se debe a que para ello se requieren dos elementos diferentes.
La mayoría de las sustancias que se encuentran en la naturaleza, como la madera, el suelo y las rocas, son mezclas de compuestos químicos.
Una característica definitoria de un compuesto es que tiene una fórmula química. Las fórmulas describen la proporción de átomos en una sustancia. Por ejemplo, la fórmula de una molécula de agua es H 2 O. Esto indica que dos átomos de hidrógeno están unidos a un átomo de oxígeno.
Los átomos de diferentes elementos se combinan en una proporción definida para formar moléculas de compuestos. Por ejemplo, el agua ( \(H_2O\) ) representa una molécula del agua compuesta en la que dos átomos de hidrógeno se combinan con un átomo de oxígeno.
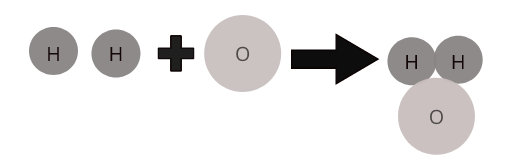
Moléculas de algunos compuestos comunes:
| Compuesto | Combinando elementos |
| Cloruro de hidrógeno ( \(HCl\) ) | hidrógeno, cloro |
| Agua ( \(H_2O\) ) | hidrógeno, oxígeno |
| Dióxido de carbono ( \(CO_2\) ) | Carbono, Oxígeno |
Cuando los átomos se acercan entre sí, se combinan para formar moléculas. Cuando se combinan, un átomo da o dona uno o más electrones que son aceptados por los otros átomos. Como resultado, se forma un enlace químico que mantiene unidos a los átomos para formar un compuesto.
La valencia es el número de electrones que un átomo puede denotar o aceptar para formar un compuesto químico o moléculas con otro átomo. Es la capacidad de combinación de un átomo de un elemento.
Una valencia es siempre un número entero. Los elementos con valencia 1 se llaman monovalentes. Los elementos con valencia 2 se llaman divalentes y los de valencia igual a 3 se llaman trivalentes. Muchos elementos tienen valencia variable (más de una valencia). Un elemento con más de una valencia se escribe como el nombre del elemento seguido de un número romano entre paréntesis para indicar la valencia. Por ejemplo, el cobre con valencia 1 se escribe Cobre[I]
Pocos elementos y su valencia:
| Elemento | Valencia |
| Hidrógeno ( \(H\) ) | 1 |
| Helio( \(He\) ) | 0 |
| Carbono( \(C\) ) | 4 |
| Nitrógeno( \(N\) ) | 3 |
| Oxígeno( \(O\) ) | 2 |
| Sodio( \(Na\) ) | 1 |
| Magnesio( \(Mg\) ) | 2 |
| Fósforo( \(P\) ) | 3 |
| Azufre( \(S\) ) | 2 |
| Cloro( \(Cl\) ) | 1 |
| Potasio( \(K\) ) | 1 |
| Calcio( \(Ca\) ) | 2 |
| Cobre( \(Cu\) ) | 1 2 |
| Hierro( \(Fe\) ) | 2 3 |
La fórmula química de un compuesto es la representación simbólica de su composición. Nos dice el número de átomos de varios elementos presentes en una molécula de un compuesto.
Reglas para escribir la fórmula de un compuesto:
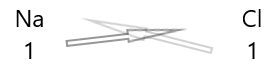
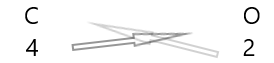
1 . Escribe el símbolo de los elementos y su valencia debajo de ellos.
2. Intercambia sus valencias y escríbelas como subíndices.
3. Si las valencias en la fórmula química son divisibles por cualquier factor, divide y simplifica.
Los compuestos químicos muestran una asombrosa variedad de características. A temperaturas y presiones ordinarias, algunos son sólidos, algunos son líquidos y algunos son gases. Los compuestos químicos son de variados colores. Algunos compuestos son altamente tóxicos para los humanos, mientras que otros son esenciales para la vida. La sustitución de un solo átomo dentro de un compuesto puede ser responsable de cambiar el color, el olor o la toxicidad de una sustancia.