Vous apprendrez :
Une molécule est un groupe de deux ou plusieurs atomes chimiquement liés. Par exemple, deux atomes d'hydrogène se combinent pour former une molécule d'hydrogène. De même, un atome de sodium se combine avec un atome de chlore pour former une molécule de chlorure de sodium. Nous pouvons également dire qu'une molécule est la plus petite particule d'un élément ou d'un composé capable d'exister de manière indépendante et présentant toutes les propriétés de cet élément ou de ce composé.
Nous pouvons diviser les molécules en molécules d'éléments et en molécules de composés .
Les molécules d'un élément sont constituées du même type d'atomes. Les molécules de certains éléments comme l'hélium (He) sont constituées d'un seul atome de cet élément. Mais les atomes d'éléments comme l'oxygène, l'azote, etc. ne peuvent pas exister indépendamment.
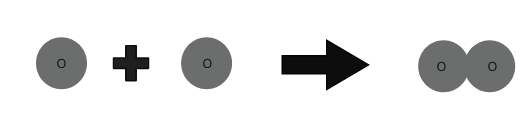
1 atome d'oxygène + 1 atome d'oxygène ⇒ 1 molécule d'oxygène
Le nombre d'atomes présents dans une molécule d'un élément s'appelle son atomicité. L'atomicité peut être monoatomique, diatomique, triatomique et polyatomique.
| Atomicité | Nombre d'atomes | Exemples |
| Monoatomique | 1 | Gaz nobles tels que l'hélium( \(He\) ), le néon( \(Ne\) ) |
| Diatomique | 2 | Hydrogène( \(H_2\) ) Chlore( \(Cl_2\) ) |
| Triatomique | 3 | Ozone( \(O_3\) ) |
| polyatomique | > 2 | Phosphore( \(P_4\) ) Atomicité 4 Soufre( \(S_8\) ) Atomicité 8 |
Un composé chimique fait référence à une substance chimique composée de nombreuses molécules identiques composées d'atomes de plusieurs éléments réunis par des liaisons chimiques. Deux atomes d'un même élément liés dans une molécule ne forment pas un composé chimique, car cela nécessite deux éléments différents.
La plupart des substances trouvées dans la nature - comme le bois, le sol et les roches - sont des mélanges de composés chimiques.
Une caractéristique déterminante d'un composé est qu'il a une formule chimique. Les formules décrivent le rapport des atomes dans une substance. Par exemple, la formule d'une molécule d'eau est H 2 O. Cela indique que deux atomes d'hydrogène sont liés à un atome d'oxygène.
Les atomes de différents éléments se combinent dans une proportion définie pour former des molécules de composés. Par exemple, l'eau ( \(H_2O\) ) représente une molécule du composé eau dans laquelle deux atomes d'hydrogène se combinent avec un atome d'oxygène.
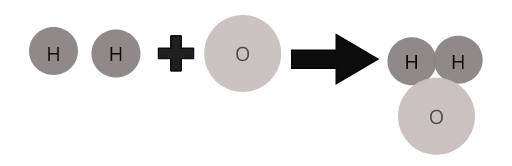
Molécules de certains composés courants :
| Composé | Combiner des éléments |
| Chlorure d'hydrogène ( \(HCl\) ) | Hydrogène, Chlore |
| Eau ( \(H_2O\) ) | Hydrogène, Oxygène |
| Dioxyde de carbone ( \(CO_2\) ) | Carbone, Oxygène |
Lorsque les atomes se rapprochent les uns des autres, ils se combinent pour former des molécules. Lorsqu'ils se combinent, un atome donne ou donne un ou plusieurs électrons qui sont acceptés par les autres atomes. En conséquence, une liaison chimique est formée qui maintient les atomes ensemble pour former un composé.
La valence est le nombre d'électrons qu'un atome peut désigner ou accepter pour former un composé chimique ou des molécules avec un autre atome. C'est la capacité de combinaison d'un atome d'un élément.
Une valence est toujours un nombre entier. Les éléments de valence 1 sont dits monovalents. Les éléments de valence 2 sont dits divalents et les éléments de valence égale à 3 sont dits trivalents. De nombreux éléments ont une valence variable (plus d'une valence). Un élément avec plus d'une valence est écrit comme le nom de l'élément suivi d'un chiffre romain entre parenthèses pour indiquer la valence. Par exemple, le cuivre de valence 1 s'écrit Cuivre[I]
Quelques éléments et leur valence :
| Élément | Valence |
| Hydrogène ( \(H\) ) | 1 |
| Hélium( \(He\) ) | 0 |
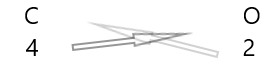
| Carbone( \(C\) ) | 4 |
| Azote( \(N\) ) | 3 |
| Oxygène( \(O\) ) | 2 |
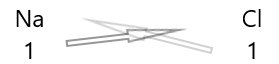
| Sodium( \(Na\) ) | 1 |
| Magnésium( \(Mg\) ) | 2 |
| Phosphore( \(P\) ) | 3 |
| Soufre( \(S\) ) | 2 |
| Chlore( \(Cl\) ) | 1 |
| Potassium( \(K\) ) | 1 |
| Calcium( \(Ca\) ) | 2 |
| Cuivre( \(Cu\) ) | 1 2 |
| Fer( \(Fe\) ) | 2 3 |
La formule chimique d'un composé est la représentation symbolique de sa composition. Il nous indique le nombre d'atomes de divers éléments présents dans une molécule d'un composé.
Règles d'écriture de la formule d'un composé :
1 . Écrivez le symbole des éléments et leur valence en dessous.
2. Intervertissez leur valence et écrivez-les en indices.
3. Si les valences dans la formule chimique sont divisibles par n'importe quel facteur, divisez et simplifiez.
Les composés chimiques présentent un éventail ahurissant de caractéristiques. Aux températures et pressions ordinaires, certains sont des solides, d'autres des liquides et d'autres des gaz. Les composés chimiques sont de couleurs variées. Certains composés sont hautement toxiques pour l'homme, alors que d'autres sont essentiels à la vie. La substitution d'un seul atome dans un composé peut être responsable de la modification de la couleur, de l'odeur ou de la toxicité d'une substance.