Anda akan belajar :
Molekul adalah sekelompok dua atau lebih atom yang bergabung secara kimiawi. Misalnya, dua atom hidrogen bergabung membentuk satu molekul hidrogen. Demikian pula, satu atom natrium bergabung dengan satu atom klorin untuk membentuk molekul natrium klorida. Bisa juga dikatakan, molekul adalah partikel terkecil dari suatu unsur atau senyawa yang mampu berdiri sendiri dan menunjukkan semua sifat unsur atau senyawa tersebut.
Kita dapat membagi molekul menjadi molekul unsur dan molekul senyawa .
Molekul suatu unsur terbuat dari jenis atom yang sama. Molekul dari beberapa unsur seperti helium (He) hanya tersusun dari satu atom unsur tersebut. Tetapi atom unsur seperti oksigen, nitrogen, dll. tidak dapat eksis secara mandiri.
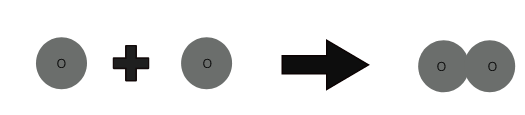
1 atom oksigen + 1 atom oksigen ⇒ 1 molekul oksigen
Jumlah atom yang ada dalam molekul suatu unsur disebut atomisitasnya. Atomisitas dapat berupa monoatomik, diatomik, triatomik , dan poliatomik.
| Atomisitas | Jumlah atom | Contoh |
| Monoatomik | 1 | Gas mulia seperti Helium( \(He\) ), Neon( \(Ne\) ) |
| Diatomik | 2 | Hidrogen( \(H_2\) ) Klorin( \(Cl_2\) ) |
| Triatomik | 3 | Ozon( \(O_3\) ) |
| Poliatomik | > 2 | Fosfor( \(P_4\) ) Atomisitas 4 Sulfur( \(S_8\) ) Atomicity 8 |
Senyawa kimia mengacu pada zat kimia yang tersusun dari banyak molekul identik yang terdiri dari atom-atom dari lebih dari satu unsur yang disatukan oleh ikatan kimia. Dua atom dari unsur yang sama terikat dalam molekul tidak membentuk senyawa kimia, hal ini karena membutuhkan dua unsur yang berbeda.
Sebagian besar zat yang ditemukan di alam – seperti kayu, tanah, dan batu – adalah campuran senyawa kimia.
Ciri yang menentukan dari suatu senyawa adalah bahwa ia memiliki rumus kimia. Rumus menggambarkan rasio atom dalam suatu zat. Misalnya, rumus molekul air adalah H 2 O. Hal ini menunjukkan bahwa dua atom hidrogen terikat pada satu atom oksigen.
Atom-atom dari unsur yang berbeda bergabung bersama dalam proporsi tertentu untuk membentuk molekul senyawa. Misalnya, air ( \(H_2O\) ) mewakili molekul air majemuk di mana dua atom hidrogen bergabung dengan satu atom oksigen.
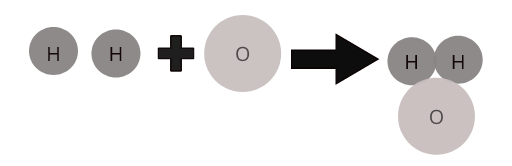
Molekul dari beberapa senyawa umum:
| Menggabungkan | Menggabungkan elemen |
| Hidrogen klorida ( \(HCl\) ) | Hidrogen, Klorin |
| Air ( \(H_2O\) ) | Hidrogen, Oksigen |
| Karbon dioksida ( \(CO_2\) | Karbon, Oksigen |
Ketika atom mendekat satu sama lain, mereka bergabung membentuk molekul. Ketika mereka bergabung, satu atom memberi atau menyumbangkan satu atau lebih elektron yang diterima oleh atom lain. Akibatnya, ikatan kimia terbentuk yang menyatukan atom untuk membentuk senyawa.
Valensi adalah jumlah elektron yang dapat ditunjukkan atau diterima oleh atom untuk membentuk senyawa atau molekul kimia dengan atom lain. Ini adalah kapasitas penggabungan atom suatu unsur.
Sebuah valensi selalu bilangan bulat. Unsur dengan valensi 1 disebut monovalen. Elemen dengan valensi 2 disebut divalen dan valensi sama dengan 3 disebut trivalen. Banyak elemen memiliki valensi variabel (lebih dari satu valensi). Suatu unsur yang bervalensi lebih dari satu ditulis sebagai nama unsur tersebut diikuti dengan angka romawi di dalam tanda kurung untuk menunjukkan valensinya. Misalnya, tembaga dengan valensi 1 ditulis sebagai Tembaga[I]
Beberapa elemen dan valensinya:
| Elemen | Valensi |
| Hidrogen ( \(H\) ) | 1 |
| Helium( \(He\) ) | 0 |
| Karbon( \(C\) ) | 4 |
| Nitrogen( \(N\) ) | 3 |
| Oksigen( \(O\) ) | 2 |
| Natrium( \(Na\) ) | 1 |
| Magnesium( \(Mg\) ) | 2 |
| Fosfor( \(P\) ) | 3 |
| Belerang( \(S\) ) | 2 |
| Klorin( \(Cl\) ) | 1 |
| Kalium( \(K\) ) | 1 |
| Kalsium ( \(Ca\) ) | 2 |
| Tembaga( \(Cu\) ) | 1 2 |
| Besi( \(Fe\) ) | 2 3 |
Rumus kimia suatu senyawa adalah representasi simbolis dari komposisinya. Ini memberi tahu kita jumlah atom dari berbagai unsur yang ada dalam satu molekul suatu senyawa.
Aturan penulisan rumus suatu senyawa:
1 . Tuliskan lambang unsur dan valensinya di bawahnya.
2. Tukarkan valensinya dan tuliskan sebagai subskrip.
3. Jika valensi dalam rumus kimia habis dibagi faktor apa pun, bagi dan sederhanakan.
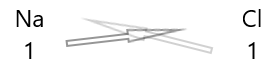
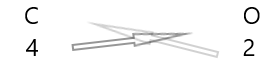
Senyawa kimia menunjukkan serangkaian karakteristik yang membingungkan. Pada suhu dan tekanan biasa, ada yang padat, ada yang cair dan ada yang gas. Senyawa kimia memiliki warna yang bervariasi. Beberapa senyawa sangat beracun bagi manusia, sedangkan yang lain sangat penting untuk kehidupan. Substitusi hanya satu atom dalam suatu senyawa mungkin bertanggung jawab untuk mengubah warna, bau, atau toksisitas suatu zat.