Та сурах болно :
Молекул гэдэг нь химийн нэгдлээс бүрдсэн хоёр ба түүнээс дээш атомын бүлэг юм. Жишээлбэл, устөрөгчийн хоёр атом нийлж устөрөгчийн молекул үүсгэдэг. Үүний нэгэн адил натрийн нэг атом хлорын нэг атомтай нийлж натрийн хлоридын молекул үүсгэдэг. Молекул нь бие даасан оршин тогтнох чадвартай, элемент эсвэл нэгдлийн бүх шинж чанарыг харуулдаг элемент эсвэл нэгдлүүдийн хамгийн жижиг бөөмс юм.
Бид молекулуудыг элементийн молекул, нэгдлийн молекул болгон хувааж болно.
Элементийн молекулууд нь ижил төрлийн атомуудаас бүрддэг. Гели (He) зэрэг зарим элементийн молекулууд нь тухайн элементийн зөвхөн нэг атомаас бүрддэг. Гэвч хүчилтөрөгч, азот гэх мэт элементүүдийн атомууд бие даан оршин тогтнох боломжгүй.
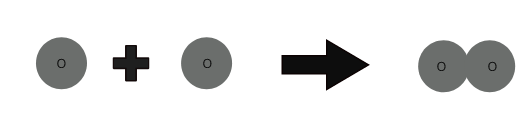
1 хүчилтөрөгчийн атом + 1 хүчилтөрөгчийн атом ⇒ 1 хүчилтөрөгчийн молекул
Элементийн молекулд агуулагдах атомын тоог түүний атом чанар гэж нэрлэдэг . Атом чанар нь нэг атомт, хоёр атомт, гурван атомт, олон атомт байж болно .
| Атом чанар | Атомын тоо | Жишээ |
| Моноатом | 1 | Helium( \(He\) ), Neon( \(Ne\) ) зэрэг үнэт хийнүүд |
| Хоёр атомт | 2 | Устөрөгч( \(H_2\) ) Хлор( \(Cl_2\) ) |
| Гурвалсан атом | 3 | Озон( \(O_3\) ) |
| Олон атомт | > 2 | Фосфор( \(P_4\) ) Атом чанар 4 Хүхэр( \(S_8\) ) Атом чанар 8 |
Химийн нэгдэл гэдэг нь нэгээс олон элементийн атомуудаас бүрдэж, химийн холбоогоор холбогдсон олон ижил молекулуудаас бүрдэх химийн бодисыг хэлнэ. Молекулд холбогдсон нэг элементийн хоёр атом нь химийн нэгдэл үүсгэдэггүй, учир нь энэ нь хоёр өөр элемент шаарддаг.
Байгальд байдаг мод, хөрс, чулуу зэрэг ихэнх бодисууд нь химийн нэгдлүүдийн холимог юм.
Нэгдлийн тодорхойлогч шинж чанар нь химийн томъёотой байдаг. Томъёо нь бодис дахь атомуудын харьцааг тодорхойлдог. Жишээлбэл, усны молекулын томъёо нь H 2 O. Энэ нь хоёр устөрөгчийн атомыг нэг хүчилтөрөгчийн атомтай холбосон болохыг харуулж байна.
Янз бүрийн элементийн атомууд тодорхой хувь хэмжээгээр нийлж нэгдлүүдийн молекулуудыг үүсгэдэг. Жишээлбэл, ус ( \(H_2O\) ) нь устөрөгчийн хоёр атом нь хүчилтөрөгчийн нэг атомтай нийлдэг нийлмэл усны молекулыг илэрхийлдэг.
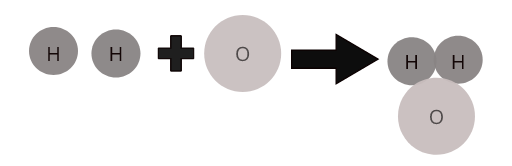
Зарим нийтлэг нэгдлүүдийн молекулууд:
| Нийлмэл | Элементүүдийг нэгтгэх |
| Устөрөгчийн хлорид ( \(HCl\) ) | Устөрөгч, хлор |
| Ус ( \(H_2O\) ) | Устөрөгч, хүчилтөрөгч |
| Нүүрстөрөгчийн давхар исэл ( \(CO_2\) ) | Нүүрстөрөгч, хүчилтөрөгч |
Атомууд бие биедээ ойртоход тэд нэгдэж молекул үүсгэдэг. Тэдгээрийг нэгтгэх үед нэг атом нь бусад атомуудад хүлээн зөвшөөрөгдсөн нэг буюу хэд хэдэн электроныг өгдөг эсвэл өгдөг. Үүний үр дүнд нэгдэл үүсгэхийн тулд атомуудыг нэгтгэсэн химийн холбоо үүсдэг.
Валент гэдэг нь атом өөр атомтай химийн нэгдэл эсвэл молекул үүсгэхийн тулд тэмдэглэж, хүлээн зөвшөөрч чадах электронуудын тоо юм. Энэ нь элементийн атомыг нэгтгэх чадвар юм.
Валент нь үргэлж бүхэл тоо юм. 1-р валенттай элементүүдийг моновалент гэж нэрлэдэг. 2-р валенттай элементүүдийг хоёр валенттай, 3-тай тэнцэх валентыг гурвалсан гэж нэрлэдэг . Олон элемент нь хувьсах валенттай (нэгээс олон валенттай). Нэгээс олон валенттай элементийг элементийн нэрээр бичээд валентыг нь харуулахын тулд хаалтанд ром тоогоор бичнэ. Жишээлбэл, 1 валенттай зэсийг Зэс[I] гэж бичдэг.
Цөөн элемент ба тэдгээрийн валент байдал:
| Элемент | Валенс |
| Устөрөгч ( \(H\) ) | 1 |
| Гели ( \(He\) ) | 0 |
| Нүүрстөрөгч( \(C\) ) | 4 |
| Азот( \(N\) ) | 3 |
| Хүчилтөрөгч( \(O\) ) | 2 |
| Натри( \(Na\) ) | 1 |
| Магни( \(Mg\) ) | 2 |
| Фосфор( \(P\) ) | 3 |
| Хүхэр( \(S\) ) | 2 |
| Хлор( \(Cl\) ) | 1 |
| Кали ( \(K\) ) | 1 |
| Кальци ( \(Ca\) ) | 2 |
| Зэс( \(Cu\) ) | 1 2 |
| Төмөр( \(Fe\) ) | 2 3 |
Нэгдлийн химийн томъёо нь түүний найрлагын бэлгэдлийн илэрхийлэл юм. Энэ нь нэгдлийн нэг молекулд агуулагдах янз бүрийн элементийн атомын тоог хэлж өгдөг.
Нэгдлийн томъёог бичих дүрэм:
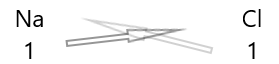
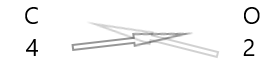
1 . Элементүүдийн тэмдэг, тэдгээрийн валентыг доор нь бич.
2. Тэдний валентыг сольж, доод тэмдэгтээр бич.
3. Химийн томьёо дахь валент нь аль нэг хүчин зүйлд хуваагддаг бол хувааж хялбаршуулна.
Химийн нэгдлүүд нь гайхалтай олон тооны шинж чанарыг харуулдаг. Энгийн температур, даралтад зарим нь хатуу, зарим нь шингэн, зарим нь хий байдаг. Химийн нэгдлүүд нь янз бүрийн өнгөтэй байдаг. Зарим нэгдлүүд нь хүний хувьд маш хортой байдаг бол зарим нь амьдралд зайлшгүй шаардлагатай байдаг. Нэгдлийн доторх ганц атомыг орлуулах нь тухайн бодисын өнгө, үнэр, хоруу чанарыг өөрчлөх үүрэгтэй.