သင်ယူရလိမ့်မည်
မော်လီကျူး ဆိုသည်မှာ ဓာတုဗေဒနည်းဖြင့် ပေါင်းစပ်ထားသော အက်တမ်နှစ်ခု သို့မဟုတ် ထို့ထက်ပိုသော အုပ်စုတစ်စုဖြစ်သည်။ ဥပမာအားဖြင့်၊ ဟိုက်ဒရိုဂျင် အက်တမ်နှစ်ခုသည် ဟိုက်ဒရိုဂျင်၏ မော်လီကျူးတစ်ခုအဖြစ် ပေါင်းစပ်သည်။ ထို့အတူ ဆိုဒီယမ်၏ အက်တမ်တစ်ခုသည် ဆိုဒီယမ်ကလိုရိုက်၏ မော်လီကျူးတစ်ခုအဖြစ် ကလိုရင်း၏ အက်တမ်တစ်ခုနှင့် ပေါင်းစပ်သည်။ မော်လီကျူး သည် ဒြပ်စင်တစ်ခု၏ အသေးငယ်ဆုံး အမှုန်အမွှား သို့မဟုတ် အမှီအခိုကင်းသော တည်ရှိနိုင်စွမ်းရှိသော ဒြပ်ပေါင်းတစ်ခုဖြစ်ပြီး ထိုဒြပ်စင် သို့မဟုတ် ဒြပ်ပေါင်း၏ ဂုဏ်သတ္တိအားလုံးကို ပြသသည်ဟုလည်း ဆိုနိုင်သည်။
ကျွန်ုပ်တို့သည် မော်လီကျူးများကို ဒြပ်စင်များ၏ မော်လီကျူးများ နှင့် ဒြပ်ပေါင်းများ၏ မော်လီကျူးများအဖြစ် ပိုင်းခြားနိုင်ပါသည်။
ဒြပ်စင်တစ်ခု၏ မော်လီကျူးများကို တူညီသော အက်တမ်များဖြင့် ပြုလုပ်ထားသည်။ ဟီလီယမ် (He) ကဲ့သို့သော ဒြပ်စင်အချို့၏ မော်လီကျူးများကို ထိုဒြပ်စင်၏ အက်တမ်တစ်ခုသာဖြင့် ပြုလုပ်ထားသည်။ သို့သော် အောက်ဆီဂျင်၊ နိုက်ထရိုဂျင်စသည့် ဒြပ်စင်များ၏ အက်တမ်များသည် သီးခြားတည်ရှိနေ၍ မရပေ။
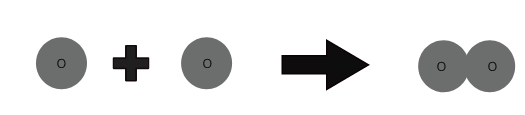
အောက်ဆီဂျင် 1 အက်တမ် + အောက်ဆီဂျင် 1 အက်တမ် ⇒ အောက်ဆီဂျင် 1 မော်လီကျူး
ဒြပ်စင်တစ်ခု၏ မော်လီကျူးတွင်ပါရှိသော အက်တမ်အရေအတွက်ကို ၎င်း၏ အက်တမ် (atomicity) ဟုခေါ်သည်။ အဏုမြူဓာတ်သည် မိုနိုအက်တမ်၊ ဒိုင်ယာတိုမစ်၊ ထရီအာတိုမစ် နှင့် ပေါလီအက်တမ် ဖြစ်နိုင်သည်။
| ပြည်တော်သာ | အက်တမ်အရေအတွက် | ဥပမာများ |
| Monoatomic | ၁ | ဟီလီယမ်( \(He\) )၊ နီယွန်( \(Ne\) ) ကဲ့သို့သော မြင့်မြတ်သော ဓာတ်ငွေ့များ၊ |
| Diatomic | ၂ | ဟိုက်ဒရိုဂျင်( \(H_2\) ) ကလိုရင်း( \(Cl_2\) ) |
| Triatomic | ၃ | အိုဇုန်း( \(O_3\) ) |
| Polyatomic | > ၂ | ဖော့စဖရပ်( \(P_4\) ) အနုမြူဓာတ် ၄ ဆာလဖာ( \(S_8\) ) အနုမြူဓာတ် ၈ |
ဓာတုဒြပ်ပေါင်းဆိုသည်မှာ ဓာတုနှောင်ကြိုးများဖြင့် ပေါင်းစပ်ထားသော ဒြပ်စင်တစ်ခုထက်ပိုသော အက်တမ်များနှင့် ဖွဲ့စည်းထားသည့် ထပ်တူထပ်မျှ မော်လီကျူးများစွာဖြင့် ဖွဲ့စည်းထားသည့် ဓာတုပစ္စည်းကို ရည်ညွှန်းသည်။ မော်လီကျူးတစ်ခုတွင် ဆက်စပ်နေသော တူညီသောဒြပ်စင်နှစ်ခုမှ အက်တမ်နှစ်ခုသည် ဓာတုဒြပ်ပေါင်းတစ်ခု မဖွဲ့စည်းနိုင်သောကြောင့် ၎င်းသည် မတူညီသောဒြပ်စင်နှစ်ခု လိုအပ်သောကြောင့်ဖြစ်သည်။
သစ်သား၊ မြေဆီလွှာ နှင့် ကျောက်ဆောင်များ ကဲ့သို့သော သဘာဝတွင် တွေ့ရသော အရာအများစုသည် ဓာတုဒြပ်ပေါင်းများ ရောနှောထားသည်။
ဒြပ်ပေါင်းတစ်ခု၏ အဓိပ္ပါယ်ဖွင့်ဆိုချက်မှာ ဓာတုဖော်မြူလာ ပါ၀င်သည် ။ ဖော်မြူလာများက အရာဝတ္ထုတစ်ခုရှိ အက်တမ်များ၏ အချိုးကို ဖော်ပြသည်။ ဥပမာအားဖြင့်၊ ရေမော်လီကျူးတစ်ခု၏ဖော်မြူလာမှာ H 2 O ဖြစ်သည်။ ၎င်းသည် ဟိုက်ဒရိုဂျင်အက်တမ်နှစ်ခုကို အောက်ဆီဂျင်အက်တမ်တစ်ခုနှင့် ချိတ်ဆက်ထားကြောင်း ဖော်ပြသည်။
မတူညီသောဒြပ်စင်များ၏ အက်တမ်များသည် ဒြပ်ပေါင်းများ၏ မော်လီကျူးများဖွဲ့စည်းရန် တိကျသောအချိုးအစားဖြင့် ပေါင်းစပ်ထားသည်။ ဥပမာအားဖြင့်၊ ရေ ( \(H_2O\) ) သည် ဟိုက်ဒရိုဂျင် အက်တမ်နှစ်ခုကို အောက်ဆီဂျင် အက်တမ်တစ်ခုနှင့် ပေါင်းစပ်ထားသည့် ဒြပ်ပေါင်းရေ၏ မော်လီကျူးတစ်ခုကို ကိုယ်စားပြုသည်။
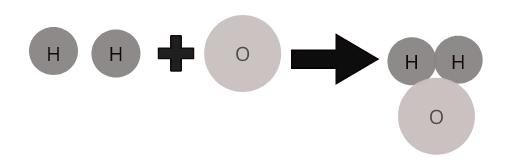
ဘုံဒြပ်ပေါင်းအချို့၏ မော်လီကျူးများ
| ခြံဝင်း | ဒြပ်စင်များပေါင်းစပ်ခြင်း။ |
| ဟိုက်ဒရိုဂျင်ကလိုရိုက် ( \(HCl\) ) | ဟိုက်ဒရိုဂျင်၊ ကလိုရင်း |
| ရေ ( \(H_2O\) ) | ဟိုက်ဒရိုဂျင်၊ အောက်ဆီဂျင် |
| ကာဗွန်ဒိုင်အောက်ဆိုဒ် ( \(CO_2\) ) | ကာဗွန်၊ အောက်ဆီဂျင် |
အက်တမ်များသည် တစ်ခုနှင့်တစ်ခု နီးကပ်လာသောအခါတွင် ၎င်းတို့သည် မော်လီကျူးများအဖြစ် ပေါင်းစပ်သွားကြသည်။ ၎င်းတို့ ပေါင်းစပ်သောအခါ၊ အက်တမ်တစ်ခုသည် အခြားအက်တမ်များမှ လက်ခံထားသော အီလက်ထရွန်တစ်ခု သို့မဟုတ် တစ်ခုထက်ပိုသော အီလက်ထရွန်များကို ပေးသည် သို့မဟုတ် လှူဒါန်းသည်။ ရလဒ်အနေဖြင့် ဒြပ်ပေါင်းတစ်ခုဖွဲ့စည်းရန် အက်တမ်များကို စုစည်းထားသည့် ဓာတုနှောင်ကြိုးတစ်ခု ဖြစ်ပေါ်လာသည်။
Valency သည် အက်တမ်တစ်ခုမှ ဓာတုဒြပ်ပေါင်းတစ်ခု သို့မဟုတ် မော်လီကျူးများဖွဲ့စည်းရန် အခြားအက်တမ်တစ်ခုအား အမှတ်အသားပြုနိုင်သော သို့မဟုတ် လက်ခံနိုင်သော အီလက်ထရွန်အရေအတွက်ဖြစ်သည်။ ၎င်းသည် ဒြပ်စင်တစ်ခု၏ အက်တမ်တစ်ခု၏ ပေါင်းစပ်စွမ်းရည်ဖြစ်သည်။
valency သည် အမြဲတမ်း ကိန်းတစ်ခုဖြစ်သည်။ valency 1 ပါသော ဒြပ်စင်များကို monovalent ဟုခေါ်သည်။ valency 2 ပါသော ဒြပ်စင်များကို divalent ဟုခေါ်ပြီး 3 နှင့် ညီမျှသော valency ကို trivalent ဟုခေါ်သည်။ ဒြပ်စင်များစွာတွင် ပြောင်းလဲနိုင်သော valency (တစ်ခုထက်ပိုသော valency) ရှိသည်။ တစ်ခုထက်ပိုသော valency ရှိသောဒြပ်စင်အား valency ကိုညွှန်ပြရန်အတွက် ကွင်းစကွင်းပိတ်များအတွင်းရှိ ရောမဂဏန်းများနောက်တွင် ဒြပ်စင်၏အမည်အဖြစ် ရေးထားသည်။ ဥပမာအားဖြင့်၊ valency 1 ပါသော ကြေးနီကို Copper[I] အဖြစ် ရေးသည်။
ဒြပ်စင်အနည်းငယ်နှင့် ၎င်းတို့၏တန်ဖိုး-
| ဒြပ် | Valency |
| ဟိုက်ဒရိုဂျင် ( \(H\) ) | ၁ |
| ဟီလီယမ်( \(He\) ) | ၀ယ်တယ်။ |
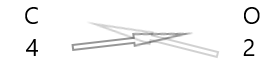
| ကာဗွန်( \(C\) ) | ၄ |
| နိုက်ထရိုဂျင်( \(N\) ) | ၃ |
| အောက်ဆီဂျင်( \(O\) ) | ၂ |
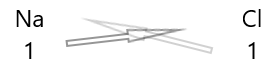
| ဆိုဒီယမ်( \(Na\) ) | ၁ |
| မဂ္ဂနီဆီယမ်( \(Mg\) ) | ၂ |
| ဖော့စဖရပ်( \(P\) ) | ၃ |
| ဆာလဖာ( \(S\) ) | ၂ |
| ကလိုရင်း( \(Cl\) ) | ၁ |
| ပိုတက်စီယမ်( \(K\) ) | ၁ |
| ကယ်လ်စီယမ်( \(Ca\) ) | ၂ |
| ကြေးနီ( \(Cu\) ) | ၁ ၂ |
| သံ( \(Fe\) ) | ၂ ၃ |
ဒြပ်ပေါင်းတစ်ခု၏ ဓာတုဗေဒဖော်မြူလာသည် ၎င်း၏ဖွဲ့စည်းမှု၏ သင်္ကေတကို ကိုယ်စားပြုသည်။ ၎င်းသည် ဒြပ်ပေါင်းတစ်ခု၏ မော်လီကျူးတစ်ခုတွင် ရှိနေသော ဒြပ်စင်အမျိုးမျိုး၏ အက်တမ်အရေအတွက်ကို ပြောပြသည်။
ဒြပ်ပေါင်းတစ်ခု၏ဖော်မြူလာကိုရေးသားခြင်းအတွက်စည်းမျဉ်းများ
၁ ။ ဒြပ်စင်များ၏ သင်္ကေတနှင့် ၎င်းတို့၏ အဓိပ္ပါယ်ကို ၎င်းတို့အောက်တွင် ရေးပါ။
2. ၎င်းတို့၏ အနှစ်သာရကို လဲလှယ်ပြီး ၎င်းတို့ကို စာတိုများအဖြစ် ရေးပါ။
3. ဓာတုဖော်မြူလာရှိ ပမာဏများကို မည်သည့်အချက်ဖြင့် ခွဲနိုင်ပါက၊ ခွဲ၍ ရိုးရှင်းအောင်ပြုလုပ်ပါ။
ဓာတုဒြပ်ပေါင်းများသည် အံ့သြဖွယ်ရာ လက္ခဏာရပ်များကို ပြသသည်။ သာမန်အပူချိန်နှင့် ဖိအားများတွင် အချို့သည် အစိုင်အခဲများ၊ အချို့မှာ အရည်များဖြစ်ပြီး အချို့မှာ ဓာတ်ငွေ့များဖြစ်သည်။ ဓာတုဒြပ်ပေါင်းများသည် အရောင်အမျိုးမျိုးရှိသည်။ အချို့ဒြပ်ပေါင်းများသည် လူကို အဆိပ်အတောက်ဖြစ်စေသော်လည်း အခြားဓာတ်များသည် အသက်အတွက် မရှိမဖြစ်လိုအပ်သည်။ ဒြပ်ပေါင်းတစ်ခုအတွင်းရှိ အက်တမ်တစ်လုံးတည်းကိုသာ အစားထိုးခြင်းသည် အရာဝတ္ထုတစ်ခု၏ အရောင်၊ အနံ့ သို့မဟုတ် အဆိပ်အတောက်ကို ပြောင်းလဲခြင်းအတွက် တာဝန်ရှိနိုင်သည်။