Je leert :
Een molecuul is een groep van twee of meer atomen die chemisch met elkaar verbonden zijn. Twee waterstofatomen combineren zich bijvoorbeeld tot een molecuul waterstof. Evenzo combineert één atoom natrium met één chlooratoom om een molecuul natriumchloride te vormen. We kunnen ook zeggen dat een molecuul het kleinste deeltje van een element of een verbinding is dat onafhankelijk kan bestaan en alle eigenschappen van dat element of die verbinding vertoont.
We kunnen moleculen verdelen in moleculen van elementen en moleculen van verbindingen .
Moleculen van een element zijn gemaakt van hetzelfde type atomen. Moleculen van sommige elementen zoals helium (He) zijn gemaakt van slechts één atoom van dat element. Maar atomen van elementen zoals zuurstof, stikstof, enz. kunnen niet onafhankelijk bestaan.
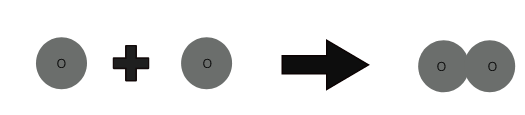
1 zuurstofatoom + 1 zuurstofatoom ⇒ 1 zuurstofmolecuul
Het aantal atomen dat aanwezig is in een molecuul van een element wordt de atomiciteit genoemd. Atomiciteit kan monoatomisch, diatomisch, triatomisch en polyatomisch zijn.
| atomiciteit | Aantal atomen | Voorbeelden |
| Eenatomig | 1 | Edelgassen zoals Helium( \(He\) ), Neon( \(Ne\) ) |
| diatomisch | 2 | Waterstof( \(H_2\) ) Chloor( \(Cl_2\) ) |
| Triatomisch | 3 | Ozon( \(O_3\) ) |
| Polyatomisch | > 2 | Fosfor( \(P_4\) ) Atomiciteit 4 Zwavel( \(S_8\) ) Atomiciteit 8 |
Een chemische verbinding verwijst naar een chemische stof die is samengesteld uit veel identieke moleculen die zijn samengesteld uit atomen van meer dan één element die met elkaar zijn verbonden door chemische bindingen. Twee atomen van hetzelfde element gebonden in een molecuul vormen geen chemische verbinding, dit komt omdat hiervoor twee verschillende elementen nodig zijn.
De meeste stoffen die in de natuur voorkomen – zoals hout, aarde en stenen – zijn mengsels van chemische verbindingen.
Een bepalend kenmerk van een verbinding is dat het een chemische formule heeft. Formules beschrijven de verhouding van atomen in een stof. De formule van een watermolecuul is bijvoorbeeld H 2 O. dit geeft aan dat twee waterstofatomen gebonden zijn aan één zuurstofatoom.
Atomen van verschillende elementen combineren zich in een bepaalde verhouding om moleculen van verbindingen te vormen. Water ( \(H_2O\) ) vertegenwoordigt bijvoorbeeld een molecuul van de samengestelde water waarin twee atomen waterstof combineren met één atoom zuurstof.
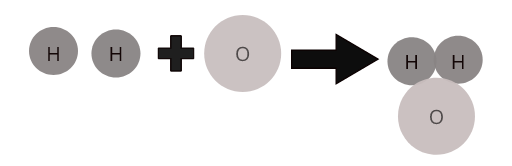
Moleculen van enkele veel voorkomende verbindingen:
| Verbinding | Elementen combineren |
| Waterstofchloride ( \(HCl\) ) | Waterstof, Chloor |
| Water ( \(H_2O\) ) | Waterstof, zuurstof |
| Kooldioxide ( \(CO_2\) ) | Koolstof, zuurstof |
Wanneer atomen dichter bij elkaar komen, combineren ze om moleculen te vormen. Wanneer ze combineren, geeft of doneert één atoom een of meer elektronen die door de andere atomen worden geaccepteerd. Als gevolg hiervan wordt een chemische binding gevormd die atomen bij elkaar houdt om een verbinding te vormen.
Valentie is het aantal elektronen dat een atoom kan aanduiden of accepteren om een chemische verbinding of moleculen met een ander atoom te vormen. Het is het combinerende vermogen van een atoom van een element.
Een valentie is altijd een geheel getal. Elementen met valentie 1 worden monovalent genoemd. Elementen met valentie 2 worden tweewaardig genoemd en valentie gelijk aan 3 worden driewaardig genoemd. Veel elementen hebben een variabele valentie (meer dan één valentie). Een element met meer dan één valentie wordt geschreven als de naam van het element gevolgd door een Romeins cijfer tussen haakjes om de valentie aan te geven. Koper met valentie 1 wordt bijvoorbeeld geschreven als Copper[I]
Enkele elementen en hun valentie:
| Element | Valentie |
| Waterstof ( \(H\) ) | 1 |
| Helium( \(He\) ) | 0 |
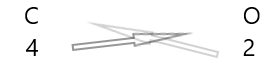
| Koolstof( \(C\) ) | 4 |
| Stikstof( \(N\) ) | 3 |
| Zuurstof( \(O\) ) | 2 |
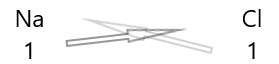
| Natrium( \(Na\) ) | 1 |
| Magnesium( \(Mg\) ) | 2 |
| Fosfor( \(P\) ) | 3 |
| Zwavel( \(S\) ) | 2 |
| Chloor( \(Cl\) ) | 1 |
| Kalium( \(K\) ) | 1 |
| Calcium( \(Ca\) ) | 2 |
| Koper( \(Cu\) ) | 1 2 |
| IJzer( \(Fe\) ) | 2 3 |
De chemische formule van een verbinding is de symbolische weergave van zijn samenstelling. Het vertelt ons het aantal atomen van verschillende elementen die aanwezig zijn in één molecuul van een verbinding.
Regels voor het schrijven van de formule van een verbinding:
1 . Schrijf het symbool van de elementen en hun valentie eronder.
2. Wissel hun valentie uit en schrijf ze als subscripts.
3. Als valenties in de chemische formule deelbaar zijn door een factor, deel en vereenvoudig dan.
Chemische verbindingen vertonen een verbijsterende reeks kenmerken. Bij normale temperaturen en drukken zijn sommige vaste stoffen, sommige vloeistoffen en sommige gassen. De chemische verbindingen zijn van verschillende kleuren. Sommige verbindingen zijn zeer giftig voor de mens, terwijl andere essentieel zijn voor het leven. De vervanging van slechts één enkel atoom in een verbinding kan verantwoordelijk zijn voor het veranderen van de kleur, geur of toxiciteit van een stof.