Você vai aprender :
Uma molécula é um grupo de dois ou mais átomos que são unidos quimicamente. Por exemplo, dois átomos de hidrogênio se combinam para formar uma molécula de hidrogênio. Da mesma forma, um átomo de sódio combina-se com um átomo de cloro para formar uma molécula de cloreto de sódio. Também podemos dizer que uma molécula é a menor partícula de um elemento ou composto que é capaz de existência independente e mostra todas as propriedades desse elemento ou composto.
Podemos dividir moléculas em moléculas de elementos e moléculas de compostos .
As moléculas de um elemento são feitas do mesmo tipo de átomos. Moléculas de alguns elementos como o hélio (He) são feitas de apenas um átomo desse elemento. Mas átomos de elementos como oxigênio, nitrogênio, etc. não podem existir independentemente.
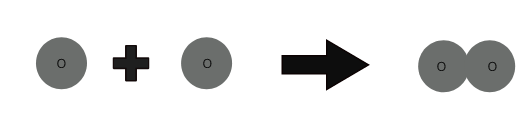
1 átomo de oxigênio + 1 átomo de oxigênio ⇒ 1 molécula de oxigênio
O número de átomos presentes em uma molécula de um elemento é chamado de atomicidade. A atomicidade pode ser monoatômica, diatômica, triatômica e poliatômica.
| Atomicidade | Número de átomos | Exemplos |
| Monoatômico | 1 | Gases nobres como Hélio( \(He\) ), Neon( \(Ne\) ) |
| Diatômico | 2 | Hidrogênio( \(H_2\) ) Cloro( \(Cl_2\) ) |
| Triatômico | 3 | Ozônio( \(O_3\) ) |
| Poliatômico | > 2 | Fósforo( \(P_4\) ) Atomicidade 4 Enxofre( \(S_8\) ) Atomicidade 8 |
Um composto químico refere-se a uma substância química que é composta de muitas moléculas idênticas que são compostas de átomos de mais de um elemento unidos por ligações químicas. Dois átomos de um mesmo elemento ligados em uma molécula não formam um composto químico, isso ocorre porque isso requer dois elementos diferentes.
A maioria das substâncias encontradas na natureza – como madeira, solo e rochas – são misturas de compostos químicos.
Uma característica definidora de um composto é que ele tem uma fórmula química. Fórmulas descrevem a proporção de átomos em uma substância. Por exemplo, a fórmula de uma molécula de água é H 2 O. isso indica que dois átomos de hidrogênio estão ligados a um átomo de oxigênio.
Átomos de diferentes elementos combinam-se em uma proporção definida para formar moléculas de compostos. Por exemplo, a água ( \(H_2O\) ) representa uma molécula do composto água na qual dois átomos de hidrogênio se combinam com um átomo de oxigênio.
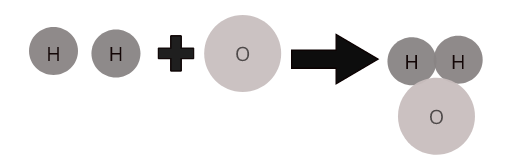
Moléculas de alguns compostos comuns:
| Composto | Combinando elementos |
| Cloreto de hidrogênio ( \(HCl\) ) | Hidrogênio, Cloro |
| Água ( \(H_2O\) ) | Hidrogênio, Oxigênio |
| Dióxido de carbono ( \(CO_2\) ) | Carbono, Oxigênio |
Quando os átomos se aproximam, eles se combinam para formar moléculas. Quando eles se combinam, um átomo dá ou doa um ou mais elétrons que são aceitos pelos outros átomos. Como resultado, é formada uma ligação química que mantém os átomos juntos para formar um composto.
Valência é o número de elétrons que um átomo pode denotar ou aceitar para formar um composto químico ou moléculas com outro átomo. É a capacidade de combinação de um átomo de um elemento.
Uma valência é sempre um número inteiro. Elementos com valência 1 são chamados monovalentes. Elementos com valência 2 são chamados divalentes e valência igual a 3 são chamados trivalentes. Muitos elementos têm valência variável (mais de uma valência). Um elemento com mais de uma valência é escrito como o nome do elemento seguido por um numeral romano entre parênteses para indicar a valência. Por exemplo, cobre com valência 1 é escrito como Cobre[I]
Alguns elementos e sua valência:
| Elemento | Valência |
| Hidrogênio ( \(H\) ) | 1 |
| Hélio( \(He\) ) | 0 |
| Carbono( \(C\) ) | 4 |
| Nitrogênio( \(N\) ) | 3 |
| Oxigênio( \(O\) ) | 2 |
| Sódio( \(Na\) ) | 1 |
| Magnésio( \(Mg\) ) | 2 |
| Fósforo( \(P\) ) | 3 |
| Enxofre( \(S\) ) | 2 |
| Cloro( \(Cl\) ) | 1 |
| Potássio( \(K\) ) | 1 |
| Cálcio( \(Ca\) ) | 2 |
| Cobre( \(Cu\) ) | 1 2 |
| Ferro( \(Fe\) ) | 2 3 |
A fórmula química de um composto é a representação simbólica de sua composição. Ele nos diz o número de átomos de vários elementos presentes em uma molécula de um composto.
Regras para escrever a fórmula de um composto:
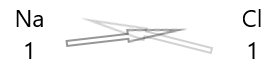
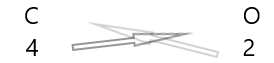
1 . Escreva o símbolo dos elementos e sua valência abaixo deles.
2. Troque suas valências e escreva-as como subscritos.
3. Se as valências na fórmula química forem divisíveis por qualquer fator, divida e simplifique.
Os compostos químicos mostram uma variedade desconcertante de características. Em temperaturas e pressões normais, alguns são sólidos, alguns são líquidos e alguns são gases. Os compostos químicos são de cores variadas. Alguns compostos são altamente tóxicos para os seres humanos, enquanto outros são essenciais para a vida. A substituição de apenas um único átomo dentro de um composto pode ser responsável por alterar a cor, odor ou toxicidade de uma substância.