Вы узнаете :
Молекула представляет собой группу из двух или более атомов, которые химически связаны друг с другом. Например, два атома водорода объединяются, образуя молекулу водорода. Точно так же один атом натрия соединяется с одним атомом хлора, образуя молекулу хлорида натрия. Можно также сказать, что молекула – это мельчайшая частица элемента или соединения, способная к самостоятельному существованию и проявляющая все свойства этого элемента или соединения.
Мы можем разделить молекулы на молекулы элементов и молекулы соединений .
Молекулы элемента состоят из атомов одного типа. Молекулы некоторых элементов, таких как гелий (He), состоят только из одного атома этого элемента. Но атомы таких элементов, как кислород, азот и т. д., не могут существовать независимо.
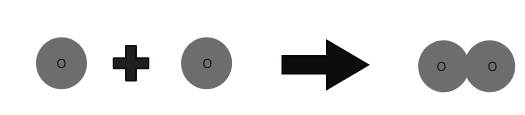
1 атом кислорода + 1 атом кислорода ⇒ 1 молекула кислорода.
Количество атомов, присутствующих в молекуле элемента, называется его атомарностью. Атомность может быть одноатомной, двухатомной, трехатомной и многоатомной.
| атомарность | Количество атомов | Примеры |
| одноатомный | 1 | Благородные газы, такие как гелий ( \(He\) ), неон( \(Ne\) ) |
| Двухатомный | 2 | Водород ( \(H_2\) ) Хлор( \(Cl_2\) ) |
| Трехатомный | 3 | Озон( \(O_3\) ) |
| Многоатомный | > 2 | Фосфор( \(P_4\) ) Атомность 4 Сера( \(S_8\) ) Атомность 8 |
Химическое соединение относится к химическому веществу, состоящему из множества одинаковых молекул, состоящих из атомов более чем одного элемента, соединенных вместе химическими связями. Два атома одного и того же элемента, связанные в молекулу, не образуют химического соединения, потому что для этого требуются два разных элемента.
Большинство встречающихся в природе веществ, таких как древесина, почва и камни, представляют собой смеси химических соединений.
Определяющей характеристикой соединения является то, что оно имеет химическую формулу. Формулы описывают соотношение атомов в веществе. Например, формула молекулы воды Н 2 О. это указывает на то, что два атома водорода связаны с одним атомом кислорода.
Атомы различных элементов соединяются друг с другом в определенной пропорции, образуя молекулы соединений. Например, вода ( \(H_2O\) ) представляет собой молекулу соединения воды, в которой два атома водорода соединяются с одним атомом кислорода.
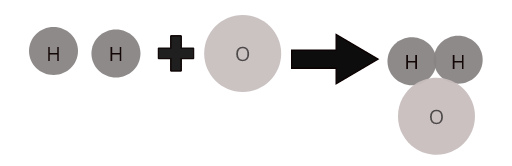
Молекулы некоторых распространенных соединений:
| Сложный | Объединение элементов |
| Хлористый водород ( \(HCl\) ) | Водород, хлор |
| Вода ( \(H_2O\) ) | Водород, Кислород |
| Углекислый газ ( \(CO_2\) ) | Углерод, кислород |
Когда атомы приближаются друг к другу, они объединяются, образуя молекулы. Когда они объединяются, один атом отдает или отдает один или несколько электронов, которые принимаются другими атомами. В результате образуется химическая связь, которая удерживает атомы вместе, образуя соединение.
Валентность — это количество электронов, которые атом может обозначать или принимать для образования химического соединения или молекул с другим атомом. Это объединяющая способность атома элемента.
Валентность всегда является целым числом. Элементы с валентностью 1 называются одновалентными. Элементы с валентностью 2 называются двухвалентными , а валентность 3 — трехвалентными. Многие элементы имеют переменную валентность (более одной валентности). Элемент с более чем одной валентностью записывается в виде имени элемента, за которым следует римская цифра в скобках для обозначения валентности. Например, медь с валентностью 1 записывается как Copper[I]
Некоторые элементы и их валентность:
| Элемент | Валентность |
| Водород ( \(H\) ) | 1 |
| Гелий( \(He\) ) ) | 0 |
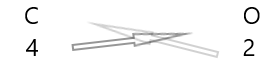
| Углерод( \(C\) ) | 4 |
| Азот( \(N\) ) | 3 |
| Кислород( \(O\) ) | 2 |
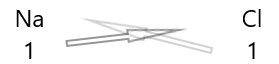
| Натрий( \(Na\) ) | 1 |
| Магний( \(Mg\) ) | 2 |
| Фосфор( \(P\) ) | 3 |
| Сера( \(S\) ) | 2 |
| Хлор( \(Cl\) ) | 1 |
| Калий( \(K\) ) | 1 |
| Кальций( \(Ca\) ) | 2 |
| Медь( \(Cu\) ) | 1 2 |
| Железо( \(Fe\) ) | 2 3 |
Химическая формула соединения является символическим представлением его состава. Он говорит нам о количестве атомов различных элементов, присутствующих в одной молекуле соединения.
Правила написания формулы соединения:
1 . Напишите символы элементов и их валентность под ними.
2. Поменять местами их валентности и записать их как нижние индексы.
3. Если валентности в химической формуле делятся на какие-либо множители, разделите и упростите.
Химические соединения демонстрируют ошеломляющий набор характеристик. При обычных температурах и давлениях некоторые из них являются твердыми, некоторые — жидкими, а некоторые — газообразными. Химические соединения окрашены в разные цвета. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.