Do të mësoni :
Një molekulë është një grup prej dy ose më shumë atomesh që janë të lidhur kimikisht së bashku. Për shembull, dy atome hidrogjeni kombinohen për të formuar një molekulë hidrogjeni. Në mënyrë të ngjashme, një atom natriumi kombinohet me një atom klori për të formuar një molekulë të klorurit të natriumit. Mund të themi gjithashtu, një molekulë është grimca më e vogël e një elementi ose një përbërjeje që është e aftë për ekzistencë të pavarur dhe tregon të gjitha vetitë e atij elementi ose përbërjeje.
Ne mund t'i ndajmë molekulat në molekula të elementeve dhe molekula të përbërjeve .
Molekulat e një elementi përbëhen nga i njëjti lloj atomesh. Molekulat e disa elementeve të tilla si heliumi (He) përbëhen nga vetëm një atom i atij elementi. Por atomet e elementeve si oksigjeni, azoti etj. nuk mund të ekzistojnë në mënyrë të pavarur.
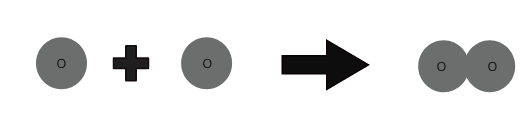
1 atom oksigjen + 1 atom oksigjen ⇒ 1 molekulë oksigjeni
Numri i atomeve të pranishëm në një molekulë të një elementi quhet atomiciteti i tij. Atomiciteti mund të jetë monoatomik, diatomik, triatomik dhe poliatomik.
| Atomiciteti | Numri i atomeve | Shembuj |
| Monoatomike | 1 | Gaze fisnike si Helium ( \(He\) ), Neoni ( \(Ne\) ) |
| Diatomike | 2 | Hidrogjeni ( \(H_2\) ) Klori ( \(Cl_2\) ) |
| Triatomike | 3 | Ozoni ( \(O_3\) ) |
| Poliatomike | > 2 | Fosfori( \(P_4\) ) Atomiciteti 4 Squfuri ( \(S_8\) ) Atomiciteti 8 |
Një përbërje kimike i referohet një substance kimike që përbëhet nga shumë molekula identike që përbëhen nga atome nga më shumë se një element të bashkuar së bashku me lidhje kimike. Dy atome nga i njëjti element të lidhur në një molekulë nuk formojnë një përbërje kimike, kjo ndodh sepse kjo kërkon dy elementë të ndryshëm.
Shumica e substancave që gjenden në natyrë - si druri, toka dhe shkëmbinjtë - janë përzierje të përbërjeve kimike.
Një karakteristikë përcaktuese e një përbërjeje është se ai ka një formulë kimike. Formulat përshkruajnë raportin e atomeve në një substancë. Për shembull, formula e një molekule uji është H 2 O. kjo tregon se dy atome hidrogjeni janë të lidhur me një atom oksigjeni.
Atomet e elementeve të ndryshëm kombinohen së bashku në një proporcion të caktuar për të formuar molekula të komponimeve. Për shembull, uji ( \(H_2O\) ) përfaqëson një molekulë të përbërjes së ujit në të cilën dy atome hidrogjen kombinohen me një atom oksigjen.
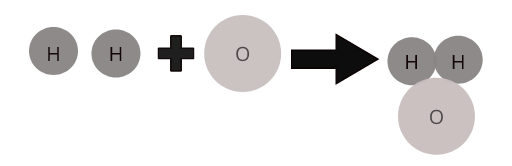
Molekulat e disa komponimeve të zakonshme:
| Kompleksi | Kombinimi i elementeve |
| Klorur hidrogjeni ( \(HCl\) ) | Hidrogjen, klor |
| Uji ( \(H_2O\) ) | Hidrogjeni, Oksigjeni |
| Dioksidi i karbonit ( \(CO_2\) ) | Karboni, Oksigjeni |
Kur atomet afrohen me njëri-tjetrin, ato kombinohen për të formuar molekula. Kur ato kombinohen, një atom jep ose dhuron një ose më shumë elektrone të cilat pranohen nga atomet e tjera. Si rezultat, formohet një lidhje kimike e cila mban atomet së bashku për të formuar një përbërje.
Valenca është numri i elektroneve që një atom mund të tregojë ose pranojë për të formuar një përbërje kimike ose molekula me një atom tjetër. Është kapaciteti kombinues i një atomi të një elementi.
Një valencë është gjithmonë një numër i plotë. Elementet me valencë 1 quhen njëvalente. Elementet me valencë 2 quhen dyvalente dhe valencë e barabartë me 3 quhen trevalente. Shumë elementë kanë valencë të ndryshueshme (më shumë se një valencë). Një element me më shumë se një valencë shkruhet si emri i elementit i ndjekur nga një numër romak në kllapa për të treguar valencën. Për shembull, bakri me valencë 1 shkruhet si Bakër[I]
Disa elementë dhe valenca e tyre:
| Elementi | Valenca |
| Hidrogjeni ( \(H\) ) | 1 |
| Helium ( \(He\) ) | 0 |
| Karboni ( \(C\) ) | 4 |
| Azoti ( \(N\) ) | 3 |
| Oksigjen ( \(O\) ) | 2 |
| Natriumi ( \(Na\) ) | 1 |
| Magnezi ( \(Mg\) ) | 2 |
| Fosfor ( \(P\) ) | 3 |
| Squfuri ( \(S\) ) | 2 |
| Klori ( \(Cl\) ) | 1 |
| Kaliumi ( \(K\) ) | 1 |
| Kalciumi ( \(Ca\) ) | 2 |
| Bakër( \(Cu\) ) | 1 2 |
| Hekuri ( \(Fe\) ) | 2 3 |
Formula kimike e një përbërjeje është paraqitje simbolike e përbërjes së tij. Ai na tregon numrin e atomeve të elementeve të ndryshëm të pranishëm në një molekulë të një përbërjeje.
Rregullat për shkrimin e formulës së një përbërjeje:
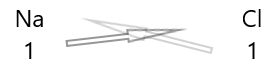
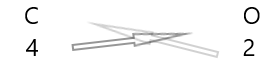
1 . Shkruani simbolin e elementeve dhe valencën e tyre poshtë tyre.
2. Ndërroni valencën e tyre dhe shkruajini ato si nënshkrime.
3. Nëse valencat në formulën kimike janë të pjestueshme me ndonjë faktor, ndajeni dhe thjeshtoni.
Përbërjet kimike tregojnë një grup të habitshëm karakteristikash. Në temperatura dhe presione të zakonshme, disa janë të ngurta, disa janë të lëngshme dhe disa janë gazra. Komponimet kimike janë me ngjyra të ndryshme. Disa përbërës janë shumë toksikë për njerëzit, ndërsa të tjerët janë thelbësorë për jetën. Zëvendësimi i vetëm një atomi të vetëm brenda një përbërjeje mund të jetë përgjegjës për ndryshimin e ngjyrës, erës ose toksicitetit të një substance.