Du kommer att lära dig :
En molekyl är en grupp av två eller flera atomer som är kemiskt sammanfogade. Till exempel kombineras två väteatomer för att bilda en vätemolekyl. På liknande sätt kombineras en natriumatom med en kloratom för att bilda en molekyl av natriumklorid. Vi kan också säga att en molekyl är den minsta partikeln av ett grundämne eller en förening som kan existera oberoende och visar alla egenskaper hos det elementet eller föreningen.
Vi kan dela upp molekyler i molekyler av grundämnen och molekyler av föreningar .
Molekyler av ett grundämne är gjorda av samma typ av atomer. Molekyler av vissa element som helium (He) är gjorda av endast en atom av det elementet. Men atomer av element som syre, kväve, etc. kan inte existera oberoende.
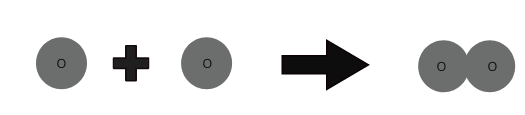
1 syreatom + 1 syreatom ⇒ 1 syremolekyl
Antalet atomer som finns i en molekyl av ett grundämne kallas dess atomicitet. Atomiciteten kan vara monoatomisk, diatomisk, triatomisk och polyatomisk.
| Atomicitet | Antal atomer | Exempel |
| Monoatomisk | 1 | Ädelgaser som Helium( \(He\) ), Neon( \(Ne\) ) |
| Diatomisk | 2 | Väte( \(H_2\) Klor( \(Cl_2\) |
| Triatomisk | 3 | Ozon( \(O_3\) |
| Polyatomisk | > 2 | Fosfor( \(P_4\) ) Atomicitet 4 Svavel( \(S_8\) ) Atomicitet 8 |
En kemisk förening hänvisar till ett kemiskt ämne som är sammansatt av många identiska molekyler som är sammansatta av atomer från mer än ett grundämne förenade med kemiska bindningar. Två atomer från samma grundämne bundna i en molekyl bildar inte en kemisk förening, detta beror på att detta kräver två olika grundämnen.
De flesta ämnen som finns i naturen – som trä, jord och stenar – är blandningar av kemiska föreningar.
En definierande egenskap hos en förening är att den har en kemisk formel. Formler beskriver förhållandet mellan atomer i ett ämne. Till exempel är formeln för en vattenmolekyl H 2 O. detta indikerar att två väteatomer är bundna till en syreatom.
Atomer av olika grundämnen kombineras i en bestämd proportion för att bilda molekyler av föreningar. Till exempel representerar vatten ( \(H_2O\) ) en molekyl av det sammansatta vattnet där två väteatomer kombineras med en syreatom.
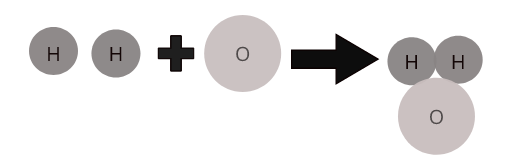
Molekyler av några vanliga föreningar:
| Förening | Att kombinera element |
| Klorväte ( \(HCl\) | Väte, klor |
| Vatten ( \(H_2O\) | Väte, syre |
| Koldioxid ( \(CO_2\) ) | Kol, syre |
När atomer kommer närmare varandra kombineras de för att bilda molekyler. När de kombineras ger eller donerar en atom en eller flera elektroner som accepteras av de andra atomerna. Som ett resultat bildas en kemisk bindning som håller samman atomer för att bilda en förening.
Valens är antalet elektroner som en atom kan beteckna eller acceptera för att bilda en kemisk förening eller molekyler med en annan atom. Det är den kombinerande förmågan hos en atom i ett element.
En valens är alltid ett heltal. Grundämnen med valens 1 kallas monovalenta. Grundämnen med valens 2 kallas divalent och valens lika med 3 kallas trivalent. Många element har variabel valens (mer än en valens). Ett element med mer än en valens skrivs som namnet på elementet följt av en romersk siffra inom parentes för att indikera valensen. Till exempel skrivs koppar med valens 1 som koppar[I]
Några element och deras valens:
| Element | Valens |
| Väte ( \(H\) | 1 |
| Helium( \(He\) ) | 0 |
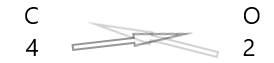
| Kol( \(C\) ) | 4 |
| Kväve( \(N\) ) | 3 |
| Syre( \(O\) ) | 2 |
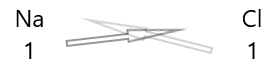
| Natrium( \(Na\) ) | 1 |
| Magnesium( \(Mg\) ) | 2 |
| Fosfor( \(P\) ) | 3 |
| Svavel( \(S\) ) | 2 |
| Klor( \(Cl\) ) | 1 |
| Kalium( \(K\) ) | 1 |
| Kalcium( \(Ca\) ) | 2 |
| Koppar( \(Cu\) ) | 1 2 |
| Järn( \(Fe\) ) | 2 3 |
Den kemiska formeln för en förening är den symboliska representationen av dess sammansättning. Det berättar för oss antalet atomer av olika grundämnen som finns i en molekyl av en förening.
Regler för att skriva formeln för en förening:
1 . Skriv symbolen för elementen och deras valens under dem.
2. Byt ut deras valens och skriv dem som prenumerationer.
3. Om valenser i den kemiska formeln är delbara med någon faktor, dividera och förenkla.
Kemiska föreningar uppvisar en förvirrande mängd egenskaper. Vid vanliga temperaturer och tryck är vissa fasta ämnen, vissa är vätskor och vissa är gaser. De kemiska föreningarna har olika färger. Vissa föreningar är mycket giftiga för människor, medan andra är livsnödvändiga. Substitutionen av endast en enda atom i en förening kan vara ansvarig för att ändra färgen, lukten eller toxiciteten hos ett ämne.