คุณจะได้เรียนรู้ :
โมเลกุล คือกลุ่มของอะตอมตั้งแต่สองอะตอมขึ้นไปที่เชื่อมต่อกันทางเคมี ตัวอย่างเช่น ไฮโดรเจน 2 อะตอมรวมกันเป็นโมเลกุลของไฮโดรเจน ในทำนองเดียวกัน โซเดียมหนึ่งอะตอมรวมกับคลอรีนหนึ่งอะตอมเพื่อสร้างโมเลกุลของโซเดียมคลอไรด์ เราอาจกล่าวได้ว่า โมเลกุล คืออนุภาคที่เล็กที่สุดของธาตุหรือสารประกอบที่สามารถดำรงอยู่อย่างอิสระและแสดงคุณสมบัติทั้งหมดของธาตุหรือสารประกอบนั้น
เราสามารถแบ่งโมเลกุลออกเป็น โมเลกุลของธาตุ และ โมเลกุลของสารประกอบ
โมเลกุลของธาตุประกอบด้วยอะตอมชนิดเดียวกัน โมเลกุลของธาตุบางชนิด เช่น ฮีเลียม (He) เกิดจากอะตอมเพียงอะตอมเดียวของธาตุนั้น แต่อะตอมของธาตุ เช่น ออกซิเจน ไนโตรเจน ฯลฯ ไม่สามารถดำรงอยู่อย่างอิสระ
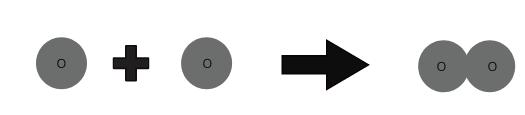
1 อะตอมของออกซิเจน + 1 อะตอมของออกซิเจน ⇒ 1 โมเลกุลของออกซิเจน
จำนวนอะตอมที่มีอยู่ในโมเลกุลของธาตุเรียกว่า อะตอมมิก ปรมาณูสามารถเป็น โมโนอะตอมมิก ไดอะตอมมิก ไตรอะตอม และ พหุอะตอม
| ปรมาณู | จำนวนอะตอม | ตัวอย่าง |
| โมโนอะตอมมิก | 1 | ก๊าซมีตระกูล เช่น ฮีเลียม( \(He\) ), Neon( \(Ne\) ) |
| ไดอะตอม | 2 | ไฮโดรเจน( \(H_2\) ) คลอรีน( \(Cl_2\) ) |
| ไตรอะตอม | 3 | โอโซน( \(O_3\) ) |
| โพลิอะตอมมิก | > 2 | ฟอสฟอรัส( \(P_4\) ) ปรมาณู4 กำมะถัน( \(S_8\) ) ปรมาณู 8 |
สารประกอบเคมี หมายถึง สารเคมีที่ประกอบด้วยโมเลกุลที่เหมือนกันหลายๆ โมเลกุลที่ประกอบด้วยอะตอมจากธาตุมากกว่าหนึ่งชนิดที่เชื่อมกันด้วยพันธะเคมี อะตอม 2 อะตอมจากธาตุเดียวกันที่สร้างพันธะในโมเลกุลไม่ก่อตัวเป็นสารประกอบทางเคมี เนื่องจากต้องใช้ธาตุ 2 ชนิดที่แตกต่างกัน
สสารส่วนใหญ่ที่พบในธรรมชาติ เช่น ไม้ ดิน และหิน เป็นส่วนผสมของสารเคมี
ลักษณะเฉพาะของสารประกอบคือมี สูตรทางเคมี สูตรอธิบายอัตราส่วนของอะตอมในสาร ตัวอย่างเช่น สูตรของโมเลกุลของน้ำคือ H 2 O ซึ่งบ่งชี้ว่าไฮโดรเจน 2 อะตอมสร้างพันธะกับอะตอมออกซิเจน 1 อะตอม
อะตอมของธาตุต่าง ๆ รวมกันในสัดส่วนที่แน่นอนเพื่อสร้างโมเลกุลของสารประกอบ ตัวอย่างเช่น น้ำ ( \(H_2O\) ) เป็นตัวแทนของโมเลกุลของน้ำผสมซึ่งไฮโดรเจนสองอะตอมรวมตัวกับออกซิเจนหนึ่งอะตอม
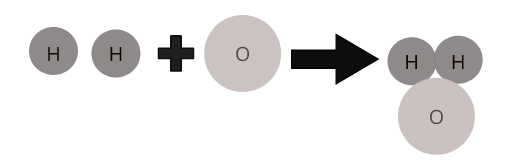
โมเลกุลของสารประกอบทั่วไป:
| สารประกอบ | การรวมองค์ประกอบ |
| ไฮโดรเจนคลอไรด์ ( \(HCl\) ) | ไฮโดรเจน คลอรีน |
| น้ำ ( \(H_2O\) ) | ไฮโดรเจน, ออกซิเจน |
| คาร์บอนไดออกไซด์ ( \(CO_2\) | คาร์บอน, ออกซิเจน |
เมื่ออะตอมเข้าใกล้กันมากขึ้น พวกมันรวมกันเป็นโมเลกุล เมื่อรวมตัวกัน อะตอมหนึ่งจะให้หรือบริจาคอิเล็กตรอนหนึ่งตัวหรือมากกว่าซึ่งอะตอมอื่นๆ ยอมรับ เป็นผลให้เกิดพันธะเคมีที่ยึดอะตอมเข้าด้วยกันเพื่อสร้างสารประกอบ
วาเลนซีคือจำนวนอิเล็กตรอนที่อะตอมสามารถแสดงหรือยอมรับเพื่อสร้างสารประกอบทางเคมีหรือโมเลกุลกับอะตอมอื่น เป็นความจุรวมของอะตอมของธาตุ
ความจุเป็นจำนวนเต็มเสมอ องค์ประกอบที่มีความจุ 1 เรียกว่า โมโนวาเลนต์ ธาตุที่มีวาเลนซี 2 เรียกว่า ไดวาเลนต์ และวาเลนซีเท่ากับ 3 เรียกว่า ไตรวาเลนต์ หลายองค์ประกอบมีวาเลนซ์แปรผัน (มากกว่าหนึ่งวาเลนซี) องค์ประกอบที่มีความจุมากกว่าหนึ่งจะถูกเขียนเป็นชื่อขององค์ประกอบตามด้วยเลขโรมันในวงเล็บเพื่อระบุความจุ ตัวอย่างเช่น ทองแดงที่มีวาเลนซ์เป็น 1 จะเขียนเป็น Copper[I]
องค์ประกอบเล็กน้อยและความจุ:
| องค์ประกอบ | ความจุ |
| ไฮโดรเจน ( \(H\) ) | 1 |
| ฮีเลียม( \(He\) ) | 0 |
| คาร์บอน( \(C\) ) | 4 |
| ไนโตรเจน( \(N\) ) | 3 |
| ออกซิเจน( \(O\) ) | 2 |
| โซเดียม( \(Na\) ) | 1 |
| แมกนีเซียม( \(Mg\) ) | 2 |
| ฟอสฟอรัส( \(P\) ) | 3 |
| กำมะถัน( \(S\) ) | 2 |
| คลอรีน( \(Cl\) ) | 1 |
| โพแทสเซียม( \(K\) ) | 1 |
| แคลเซียม( \(Ca\) ) | 2 |
| ทองแดง( \(Cu\) ) | 1 2 |
| เหล็ก( \(Fe\) ) | 2 3 |
สูตรทางเคมีของสารประกอบคือการแสดงสัญลักษณ์ขององค์ประกอบ มันบอกเราถึงจำนวนอะตอมของธาตุต่าง ๆ ที่มีอยู่ในหนึ่งโมเลกุลของสารประกอบ
กฎสำหรับการเขียนสูตรของสารประกอบ:
1 . เขียนสัญลักษณ์ของธาตุและความจุของธาตุไว้ด้านล่าง
2. แลกเปลี่ยนความจุของพวกเขาและเขียนเป็นตัวห้อย
3. ถ้าค่าความจุในสูตรเคมีหารด้วยปัจจัยใดๆ ให้หารและทำให้ง่ายขึ้น
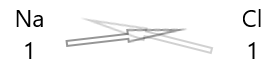
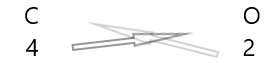
สารประกอบทางเคมีแสดงลักษณะเฉพาะที่น่าสับสน ที่อุณหภูมิและความดันปกติ บางชนิดเป็นของแข็ง บางชนิดเป็นของเหลว และบางชนิดเป็นแก๊ส สารประกอบทางเคมีมีสีต่างๆ สารประกอบบางชนิดมีความเป็นพิษสูงต่อมนุษย์ ในขณะที่สารบางชนิดมีความจำเป็นต่อชีวิต การแทนที่เพียงอะตอมเดียวภายในสารประกอบอาจทำให้สี กลิ่น หรือความเป็นพิษของสารเปลี่ยนไป