Şunları öğreneceksiniz :
Bir molekül , kimyasal olarak bir araya getirilmiş iki veya daha fazla atomdan oluşan bir gruptur. Örneğin, iki hidrojen atomu birleşerek bir hidrojen molekülü oluşturur. Benzer şekilde, bir sodyum atomu, bir sodyum klorür molekülü oluşturmak için bir klor atomu ile birleşir. Molekül , bir elementin veya bir bileşiğin bağımsız olarak var olabilen ve o elementin veya bileşiğin tüm özelliklerini gösteren en küçük parçacığıdır da diyebiliriz.
Molekülleri element moleküllerine ve bileşik moleküllerine ayırabiliriz.
Bir elementin molekülleri aynı cins atomlardan yapılır. Helyum (He) gibi bazı elementlerin molekülleri o elementin sadece bir atomundan yapılmıştır. Ancak oksijen, nitrojen vb. elementlerin atomları bağımsız olarak var olamazlar.
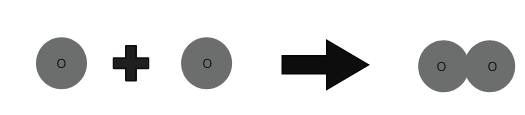
1 oksijen atomu + 1 oksijen atomu ⇒ 1 oksijen molekülü
Bir elementin molekülünde bulunan atom sayısına atomitesi denir. Atomiklik monoatomik, iki atomlu, üç atomlu ve çok atomlu olabilir.
| Atomiklik | atom sayısı | örnekler |
| tek atomlu | 1 | Helyum( \(He\) ), Neon( \(Ne\) ) gibi asil gazlar |
| iki atomlu | 2 | Hidrojen( \(H_2\) ) Klor( \(Cl_2\) ) |
| üç atomlu | 3 | Ozon( \(O_3\) ) |
| çok atomlu | > 2 | Fosfor( \(P_4\) ) Atomiklik 4 Kükürt( \(S_8\) ) Atomiklik 8 |
Bir kimyasal bileşik, kimyasal bağlarla birleştirilmiş birden fazla elementin atomlarından oluşan birçok özdeş molekülden oluşan kimyasal bir maddeyi ifade eder. Bir molekülde bağlı aynı elementten iki atom kimyasal bir bileşik oluşturmaz, çünkü bunun için iki farklı element gerekir.
Doğada bulunan çoğu madde - tahta, toprak ve kayalar gibi - kimyasal bileşiklerin karışımlarıdır.
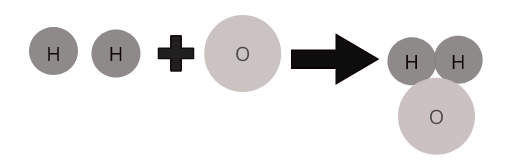
Bir bileşiğin tanımlayıcı özelliği, kimyasal bir formüle sahip olmasıdır. Formüller, bir maddedeki atomların oranını tanımlar. Örneğin, bir su molekülünün formülü H 2 O'dur. Bu, iki hidrojen atomunun bir oksijen atomuna bağlı olduğunu gösterir.
Farklı elementlerin atomları, bileşik moleküllerini oluşturmak için belirli bir oranda bir araya gelirler. Örneğin, su ( \(H_2O\) ), iki hidrojen atomunun bir oksijen atomuyla birleştiği bileşik su molekülünü temsil eder.
Bazı yaygın bileşiklerin molekülleri:
| Birleştirmek | Öğeleri birleştirme |
| Hidrojen klorür ( \(HCl\) ) | hidrojen, klor |
| Su ( \(H_2O\) ) | hidrojen, oksijen |
| Karbon dioksit ( \(CO_2\) ) | Karbon, Oksijen |
Atomlar birbirine yaklaştıkça molekülleri oluşturmak için birleşirler. Birleştiklerinde, bir atom diğer atomlar tarafından kabul edilen bir veya daha fazla elektron verir veya bağışlar. Sonuç olarak, bir bileşik oluşturmak için atomları bir arada tutan kimyasal bir bağ oluşur.
Değerlik, bir atomun gösterebileceği veya başka bir atomla kimyasal bir bileşik veya moleküller oluşturmak için kabul edebileceği elektron sayısıdır. Bir elementin atomunun birleştirme kapasitesidir.
Bir değerlik her zaman bir tam sayıdır. Değerliliği 1 olan elementlere tek değerlikli denir. Değerliği 2 olan elementlere iki değerlikli ve değeri 3'e eşit olan elementlere üç değerli denir. Birçok öğenin değişken değerliliği vardır (birden fazla değerlik). Birden fazla değerliği olan bir element, elementin adı olarak yazılır ve ardından değerliliği belirtmek için parantez içinde bir Romen rakamı gelir. Örneğin, değerliliği 1 olan bakır, Copper[I] olarak yazılır.
Birkaç element ve değerleri:
| eleman | Değerlik |
| Hidrojen ( \(H\) ) | 1 |
| Helyum( \(He\) ) | 0 |
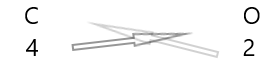
| Karbon( \(C\) ) | 4 |
| Azot( \(N\) ) | 3 |
| Oksijen( \(O\) ) | 2 |
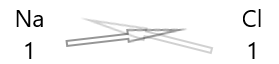
| Sodyum( \(Na\) ) | 1 |
| Magnezyum( \(Mg\) ) | 2 |
| fosfor( \(P\) ) | 3 |
| kükürt( \(S\) ) | 2 |
| Klor( \(Cl\) ) | 1 |
| Potasyum( \(K\) ) | 1 |
| Kalsiyum( \(Ca\) ) | 2 |
| Bakır( \(Cu\) ) | 1 2 |
| Demir( \(Fe\) ) | 2 3 |
Bir bileşiğin kimyasal formülü, bileşiminin sembolik temsilidir. Bize bir bileşiğin bir molekülünde bulunan çeşitli elementlerin atomlarının sayısını söyler.
Bir bileşiğin formülünü yazmak için kurallar:
1 . Elementlerin sembollerini ve altlarına değerliklerini yazınız.
2. Değerliklerini değiştirin ve alt simge olarak yazın.
3. Kimyasal formüldeki değerler herhangi bir faktöre bölünebiliyorsa, bölün ve sadeleştirin.
Kimyasal bileşikler şaşırtıcı bir dizi özellik gösterir. Olağan sıcaklık ve basınçlarda bazıları katı, bazıları sıvı ve bazıları gazdır. Kimyasal bileşikler çeşitli renklerdedir. Bazı bileşikler insanlar için oldukça zehirliyken, diğerleri yaşam için gereklidir. Bir bileşik içinde yalnızca tek bir atomun yer değiştirmesi, bir maddenin rengini, kokusunu veya toksisitesini değiştirmekten sorumlu olabilir.